Физическая химия: конспект лекций Березовчук А В
5. Процессы. Второй закон термодинамики
Второй закон термодинамики, в отличие от первого закона термодинамики, изучает все процессы, которые протекают в природе, и эти процессы можно классифицировать следующим образом.
Процессы бывают самопроизвольные, несамопроизвольные, равновесные, неравновесные.
Самопроизвольные процессы делятся на обратимые и необратимые. Второй закон термодинамики называют законом направленности процесса в изолированной системе (закон роста S). Слово «энтропия» создано в 1865 г. Р. Ю. Э. Клаузиусом – «тропе» с греческого означает превращение. В 1909 г. профессор П. Ауербах назвал царицей всех функций внутреннюю энергию, а S – тенью этой царицы. Энтропия – мера неупорядоченности системы.
Обратимые и необратимые процессы
Необратимые процессы идут без затраты работы, протекают самопроизвольно лишь в одном направлении, это такие изменения состояния в изолированной системе, когда при обращении процессов свойства всей системы меняются. К ним относятся:
1) теплопроводность при конечной разности температур;
2) расширение газа при конечной разности давлений;
3) диффузия при конечной разности концентраций.
Обратимыми процессами в изолированной системе называются такие процессы, которые можно обратить без каких-либо изменений в свойствах этой системы.
Обратимые: механические процессы в системе, где отсутствует трение (идеальная жидкость, ее движение, незатухающие колебания маятника в вакууме, незатухающие электромагнитные колебания и распространение электромагнитных волн там, где нет поглощения), которые могут возвратиться в начальное состояние.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, Na с большой скоростью движется по поверхности, так как идет выделение водорода проверить.).
Несамопроизвольные
Равновесие делится на устойчивое, неустойчивое и безразличное .
1. Постулат Клаузиуса – не может быть перехода тепла от менее нагретого к более нагретому телу.
2. Постулат Томсона – теплота наиболее холодного тела не может служить источником работы.
Теорема Карно – Клаузиуса: все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела.
Q 1 /Т 1 –
Q 2 / T 2 –
Q 1 /Т 1 = Q 2 /Т 2 –


![]()
Это четвертое уравнение второго закона термодинамики Если процесс является замкнутым, то
При необратимом процессе:
Это шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0.
S.
S = k lnW.
Действие, обратное логарифму – потенцирование :

Первый закон термодинамики определяется постоянством функции U в изолированной системе. Найдем функцию, выражающую содержание второго закона, а именно, одностороннюю направленность протекающих в изолированной системе процессов. Изменение искомой функции должно иметь для всех реальных, т. е. необратимых процессов, протекающих в изолированных системах, один и тот же знак. Второй закон термодинамики в приложении к некруговым необратимым процессам должен выражатся неравенством. Вспомним Цикл Карно. Так как любой цикл можно заменить бесконечно большим числом бесконечно малых циклов Карно, то выражение:
![]()
справедливо для любого обратимого цикла. Считая на каждом элементарном участке теплообмена Т = const, найдем, что:
![]()
и для всего цикла

Энергия Гельмгольца Изохорно-изотермический потенциал
F = U – TS
Величина (V – TS ) является свойством системы; она называется энергией Гельмгольца . Была введена Гельмгольцем в 1882 г.
dF = dU – TdS – SdT,
U = F + TS,
dF = TdS – pdV – SdT,
F – полный дифференциал.

Увеличение объема приводит к тому, что изохорно-изотермический потенциал уменьшается (тот «минус», который стоит перед Р). Повышение температуры приводит к тому, что F уменьшается.
?А равн > ?А неравн
Q = ?U + A,
A = Q – ?U,
A = T(S 2 – S 1) – (U 2 – U 1),
А = F 1 – F 2 = – ?F,
А равн = – ?F –
физический смысл изохорно-изотермического потенциала.
Убыль изохорно-изотермического потенциала равна максимальной работе, производимой системой в этом процессе; F – критерий направленности самопроизвольного процесса в изолированной системе . Для самопроизвольного процесса: AF T г < 0.
Для несамопроизвольного процесса: ?F T,V > 0. Для равновесного процесса: ?F T,V = 0.
?F V,T ? 0.
Изохорно-изотермический потенциал в самопроизвольных процессах уменьшается и, когда он достигает своего минимального значения, то наступает состояние равновесия (рис. 4).

Рис. 4
2 – несамопроизвольный процесс;
3 – равновесный процесс.
Изобарно-изотермический потенциал .
1) G (P, Т= cоnst), энергия Гиббса
G = U – TS + PV = H – TS = F + PV,
?Q = dU – Pdv + A?,
?A? = Q – dU – pdv,
?A? max = T(S 2 – S 1) – (U 2 – U 1) – p(V 2 – V 1),
?A? max = (U 1 – TS 1 + PV 1) – (U 2 – TS 2 + PV 2) = G 1 – G 2 = – ?G,
U – TS + pV = G,
A? max = – ?G.
Работа изобарно-изотермического процесса равна убыли изобарно-изотермического потенциала – физический смысл этой функции;
2) функция – полный дифференциал, однозначна, конечна, непрерывна.
G = U – TS + pV,
dG = dU – TdS – SdT + pdv + vdp,
dG = TdS – pdV – TdS – SdT + pdv + vdp,
dG = –SdT + Vdp,
Повышение температуры приводит к тому, что изобарно-изотермический потенциал уменьшается, так как перед S стоит знак «минус». Повышение давления приводит к тому, что изобарно-изотермический потенциал увеличивается, так как перед V стоит знак «плюс»;
3) G как критерий направленности процесса в изолированной системе.
Для самопроизвольного процесса: (?G ) P,T < 0. Для несамопроизвольного процесса: (?G ) P,T > 0. Для равновесного процесса: (?G) P,T = 0
?G (P, T) ? 0.
Изобарно-изотермический потенциал в самопроизвольных процессах уменьшается, и, когда он достигает своего минимума, то наступает состояние равновесия.
Рис. 5
где 1 – самопроизвольный процесс;
2 – равновесный процесс;
3 – несамопроизвольный процесс.
Совершается работа за счет?U и?H .
Противодействующие факторы. Энтальпийный фактор характеризует силу притяжения молекул. Энтропийный фактор характеризует стремление к разъединению молекул.
Энтальпия – Н Внутренняя энергия – U.
H = U + PV,
dH = dU + pdv + vdp,
U = TS – PV,
dU = TdS – SdT + pdV + Vdp,
dH = –pdV + pdV + Vdp; U = TdS + VdP.

Рис. 6
где 1 – самопроизвольный процесс,
2 – несамопроизвольный процесс,
3 – равновесный процесс,
(dH) P,T ? 0,
(dU) S,T ? 0.
Уравнения Гиббса – Гельмгольца – уравнения максимальной работы .
Они позволяют установить связь между максимальной работой равновесного процесса и теплотой неравновесного процесса
уравнение Гельмгольца (уравнение связывающее функции F и G

![]()
уравнение Гиббса (уравнение связывающее функции F и G с их температурными производными).
Уравнение Клаузиуса-Клапейрона
Оно позволяет применить второй закон термодинамики к фазовым переходам. Если рассчитать процессы, в которых совершается только работа расширения, то тогда изменение внутренней энергии
U 2 – U 1 = T(S 2 – S 1) – P(V 2 – V 1),
(U 1 – TS 1 + PV 1) = (U 2 – TS 2 + PV 2),
G 1 = G 2 – в условиях равновесия.
Предположим, что 1 моль вещества переходит из первой фазы во вторую.
I фаза => dG 1 = V 1 dp – S 1 dT.
II фаза => dG 2 = V 2 dp – S 2 dT, при равновесии dG 2 – dG 1 = 0
dG 2 – dG 1 = dp(V 2 – V 1) – dT(S 2 – S1) –
нет условного равновесия,
![]()
где dP/dT – температурный коэффициент давления,
где ? фп – теплота фазового перехода.
![]()
уравнение Клаузиуса-Клапейрона, дифференциальная форма уравнения.
Уравнение устанавливает взаимосвязь между теплотой фазового перехода, давлением, температурой и изменением молярного объема.
![]()
эмпирическая форма уравнения Клаузиуса-Клапейрона.

Рис. 7

Рис. 8
Уравнение Клаузиуса-Клапейрона изучает фазовые переходы. Фазовые переходы могут быть I рода и II рода.
I рода – характеризуются равенством изобарных потенциалов и скачкообразными изменениями S и V.
II рода – характеризуются равенством изобарных потенциалов, равенством энтропий и равенством молярных объемов.
I рода – ?G = 0, ?S ? 0, ?V ? 0.
II рода – ?G = 0, ?S = 0, ?V = 0.
Алгебраическая сумма приведенных теплот для любого обратимого кругового процесса равна нулю.
Эта подынтегральная величина – дифференциал однозначной функции состояния. Эта новая функция была введена Клаузиусом в 1865 г. и названа энтропией – S (от греч. «превращение»).
Любая система в различном состоянии имеет вполне определенное и единственное значение энтропии, точно так же, как определенное и единственное значение Р, V, T и других свойств.
Итак, энтропия выражается уравнением:
где S – это функция состояний, изменение которой dSв обратимом изотермическом процессе перехода теплоты в количество Q равно приведенной теплоте процесса.
При независимых переменных U (внутренняя энергия) может обозначаться U ВН и V (объем), или Р (давление) и Н (энтальпия). Энтропия является характеристической функцией. Характеристические функции – функции состояния системы, каждая из которых при использовании ее производных дает возможность выразить в явной форме другие термодинамические свойства системы. Напомним, в химической термодинамике их пять:
1) изобарно-изотермический потенциал (энергия Гиббса) при независимых переменных Т, Р и числе молей каждого из компонентов и. ;
2) изохорно-изотермический потенциал (энергия Гельмгольца) при независимых переменных Т, V, n i ;
3) внутренняя энергия при независимых переменных: S, V, n i ;
4) энтальпия при независимых переменных: S, Р, п i ;
5) энтропия при независимых переменных Н, Р, n i . .
В изолированных системах (U и V= const) при необратимых процессах энтропия системы возрастает, dS > 0; при обратимых – не изменяется, dS = 0.
Связь энтропии с другими термодинамическими параметрами
Для того, чтобы решить конкретную задачу, связанную с применением энтропии, надо установить зависимость между ней и другими термодинамическими параметрами. Уравнение dS = ?Q/T в сочетании с?Q = dU + PdV и?Q = dH – VdP дает уравнения:
dU = TdS – PdV,
dH = TdS + VdP.
Записав уравнение:

применительно к функциональной зависимости ?(Т, V, S) = 0, получим

Теперь найдем зависимость энтропии от температуры из уравнений:
Вот эти зависимости:
Эти два уравнения являются практически наиболее важными частными случаями общего соотношения:
TdS = CdT.
Пользуясь разными зависимостями, можно вывести другие уравнения, связывающие термодинамические параметры.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, натрий с большой скоростью движется по поверхности, так как идет выделение водорода), а калий буквально «прыгает» по воде.
Несамопроизвольные – процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Постулаты второго закона термодинамики.
1. Постулат Клаузиуса – «Не может быть перехода тепла от менее нагретого к более нагретому телу».
2. Постулат Томсона – «Теплота наиболее холодного тела не может служить источником работы».
Теорема Карно-Клаузиуса: «Все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела».
Аналитические выражения второго закона термодинамики.
1. Классическое уравнение второго закона термодинамики

где Q /Т – приведенное тепло;
Q 1 /Т 1 – приведенное тепло нагревателя;
Q 2 / T 2 – приведенное тепло холодильника;
Q 1 /Т 1 = Q 2 / T 2 – равенство приведенных теплот нагревателя и холодильника. Это второе уравнение термодинамики.
Если делим адиабатами на множество циклов Карно, то получим

Это третье уравнение второго закона термодинамики для бесконечно малого цикла Карно.
Если процесс является конечным, то
![]()
Это четвертое уравнение второго закона термодинамики
Если процесс является замкнутым, то
Это пятое уравнение второго закона термодинамики для обратимого процесса.
Интеграл по замкнутому контуру – интеграл Клаузиуса.
При необратимом процессе:
шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0.
это седьмое уравнение второго закона термодинамики. Второй закон термодинамики – закон роста S.
S = k lnW.
S = k lnW –
это формула Больцмана,
где S – энтропия – степень разупорядоченности системы;
k– постоянная Больцмана;
W – термодинамическая вероятность системы макросостояний.
Термодинамическая вероятность – число микросостояний данной системы, с помощью которых можно реализовать данное макросостояние системы (Р, Т, V).
Если W = 1, то S = 0, при температуре абсолютного нуля –273°С все виды движений прекращаются.
Термодинамическая вероятность – это число способов, которыми атомы и молекулы можно распределить в объеме.
Из книги Медицинская физика автора Подколзина Вера Александровна25. Второе начало термодинамики. Энтропия Существует несколько формулировок второго закона термодинамики: теплота сама собой не может переходить от тела с меньшей температурой к телу с большей температурой (формулировка Клаузиуса), или невозможен вечный двигатель
Из книги Физическая химия: конспект лекций автора Березовчук А В29. Физические процессы в биологических мембранах Важной частью клетки являются биологические мембраны. Они отграничивают клетку от окружающей среды, защищают ее от вредных внешних воздействий, управляют обменом веществ между клеткой и ее окружением, способствуют
Из книги Новейшая книга фактов. Том 3 [Физика, химия и техника. История и археология. Разное] автора Кондрашов Анатолий Павлович3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv Формулировки первого закона термодинамики.1. Общий запас энергии в изолированной системе остается постоянным.2. Разные формы энергии переходят друг в друга в строго эквивалентных
Из книги Атомная энергия для военных целей автора Смит Генри Деволф2. Электродные процессы Электродные процессы – процессы, связанные с переносом зарядов через границу между электродом и раствором. Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с
Из книги Курс истории физики автора Степанович Кудрявцев Павел3. Катодные и анодные процессы в гальванотехнике Основными процессами в гальванотехнике являются восстановление и снижение.На Kat – восстановление, где Kat – катод. На An – снижение, где An – анод.Электролиз H2O: Катодные реакции Последняя реакция протекает свыделением
Из книги История лазера автора Бертолотти Марио4. Стохастические процессы и самоорганизующиеся системы Стохастические процессы и самоорганизующиеся системы являются предметом изучения электрохимической синергетики. Такие процессы имеют место во всех областях: переход от ламинарного к турбулентному процессу,
Из книги Вечный двигатель - прежде и теперь. От утопии - к науке, от науки - к утопии автора Бродянский Виктор МихайловичЛЕКЦИЯ № 15. Третий закон термодинамики Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует
Из книги 4. Кинетика. Теплота. Звук автора Фейнман Ричард Филлипс Из книги Механика от античности до наших дней автора Григорьян Ашот ТиграновичКАСКАДНЫЕ И КОМБИНИРОВАННЫЕ ПРОЦЕССЫ 9.32. Во всех статистических методах разделения изотопов для получения вещества, содержащего 90 % или больше U-235 или дейтерия, необходимо много последовательных ступеней разделения. Если поток движется непрерывно от одной ступени к
Из книги автораВозникновение и развитие термодинамики. Карно Если в XVIII в. в физике (за исключением механики) господствовал эксперимент, так что физику определяли как науку «о всем том, что через опыты познать можно», то в XIX в. картина начинает меняться. Экспериментальная физика
Из книги автораВторое начало термодинамики Прогресс теплотехники не только стимулировал открытие закона сохранения и превращения энергии, но и двинул вперед теоретическое изучение тепловых явлений. Уточнялись основные понятия, создавалась аксиоматика теории теплоты,
Из книги автораВторой твердотельный лазер В сентябре 1959 г. Таунс организовал конференцию «Квантовая электроника - резонансные явления», на которой, хотя лазер еще не был создан, большинство неформальных дискуссий концентрировалось на лазерах.В этой конференции приняли участие Петер
Из книги автораГлава третья. ИДЕЯ ppm-2 и ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ У кого не уяснены принципы во всей логической полноте и последовательности, у того не только в голове сумбур, но и в делах чепуха. Н. Г.
Из книги автора Из книги автораГлава 45 ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ § 1. Внутренняя энергия§ 2. Применения§ 3. Уравнение Клаузиуса –Клайперона§ 1. Внутренняя энергияКогда приходится использовать термодинамику для дела, то оказывается, что она очень трудный и сложный предмет. В этой книге, однако, мы не
Из книги автораIX. МЕХАНИКА В РОССИИ ВО ВТОРОЙ ПОЛОВИНЕ XIX-НАЧАЛЕ XX
В физике, так как она является точной наукой, большинство догм доказывается эмпирическим путем. Именно таким образом был выведен второй закон термодинамики, который сегодня изучается в каждой школе. Необратимость тепловых процессов - вот о чем он говорит. Стоит отметить, что на начальных этапах изучения такая трактовка куда более понятна.
Общие представления
Физическим принципом, который ограничивает направления различных процессов в термодинамических системах, является второй закон термодинамики. Определение данного термина было сформировано в 19 столетии, сначала Рудольфом Клаузисом, а затем Уильямом Томсоном (лордом Кельвином). В соответствии с двумя постулатами в мире не может существовать некий вечный двигатель второго рода. Нет и не будет такой установки, которая бы тепло, исходящее от всех вещей, живых существ и явлений, превращала в энергию для своей постоянной работы. Исходя из этого было выведено правило, что КПД не может равняться единице. Сравнить это можно с работой холодильника, где температура, допустим, будет равна абсолютному нулю. В таких условиях круговой обмен теплом исключен.
Формулировка Рудольфа Клаузиса
Первым озвучил второй закон термодинамики Р. Клаузис - немецкий физик-практик и математик. По его словам, круговой процесс, в котором результат достигается путем передачи теплоты от менее нагретого тела к более нагретому, невозможен. Иными словами, температура в полной или частичной мере может свободно переходить от более теплого тела к более охлажденному, но в обратном направлении этот процесс происходить не сможет. Это наглядным образом демонстрирует нам отсутствие цикличности, замкнутого круга. Такие понятия неприемлемы для термодинамики. Между телами просто происходит обмен теплом, и в результате этих действий не производится лишняя энергия.

Постулат, выведенный лордом Кельвином
Аналогичное определение второй закон термодинамики получил в трудах Томсона - британского физика и механика. Теоретически он звучит так: «Циклический процесс, единственным результатом которого могла бы быть работа, получаемая путем охлаждения теплого тела или резервуара, невозможен». Чтобы понять более ясно такую трактовку, представим себе некую машину (в соответствии с термодинамическим постулатом она существовать не может). Она периодически охлаждает резервуар с постоянно горячей водой, получая от этого тепловую энергию. За счет этой энергии машина поднимает различные грузы, как строительный кран. При этом в ней нет мотора, силовых установок и прочего механического наполнения. В точки зрения эмпирической физики такое невозможно.

Что общего?
Теперь рассмотрим, каким образом эти две трактовки объединяются и на что в принципе опирается второй закон термодинамики. Энтропия - та самая мера хаоса, которая увеличивается в процессе обмена теплом. Именно она является связующим элементом для описания Клаузиса и Кельвина. Но вернемся немного назад. Второе начало термодинамики гласит, что при обмене теплом энергия убывает (потому получение работы никак не возможно), но при этом мера хаоса увеличивается. Этот процесс необратимый, и часто его называют стихийным. В термодинамике энтропия постоянно приумножается, но ее уничтожение невозможно. Именно поэтому даже 100 процентов энергии, которые находятся в любом теле, не могут преобразоваться в работу.

Что такое мера хаоса?
Само понятие энтропии впервые было сформулировано устами Клаузиса. Оно применялось для определения меры необратимого процесса рассеивания энергии. Это была своего рода разница отклонения реального процесса от идеального. Энтропия в замкнутых системах, где любые процессы происходят циклично, имеет постоянную величину. Если же процесс необратимый (что непосредственно касается термодинамики), то энтропия всегда имеет положительное значение. Также стоит выделить, что мера хаоса порождается абсолютно всеми процессами, которые происходят во Вселенной. При постоянных показателях объема и энергии какого-либо тела или резервуара энтропия постоянно возрастает. Если данные показатели периодически меняются, то мера хаоса может уменьшиться за счет производимой работы, но ее полное уничтожение невозможно. При этом стоит отметить, что энтропия Вселенной не уменьшается. Она остается либо в норме, либо безвозвратно увеличивается.

Наглядный пример
Второй закон термодинамики можно объяснить на стандартном примере, который часто приводят школьникам. У нас есть два тела с различной температурой. Более нагретая субстанция будет отдавать свое тепло менее нагретой до тех пор, пока их температурные показатели не сравняются. В ходе данного процесса энтропия у первого, более теплого тела уменьшится на меньший показатель, нежели она увеличится у второго, более прохладного тела. В результате подобный самопроизвольный процесс создаст энтропию системы, показатель которой будет выше, чем суммарное значение энтропий двух тел в первоначальном положении. Иными словами, мера хаоса системы двух субстанций, полученная в результате обмена теплом, увеличилась.

Тепловая смерть Вселенной
Проводя свои расследования, Клаузис пришел к выводу, что каким бы открытым нам ни казалось пространство (наша планета, ее отдельные территории, акватории и т.д.), все это находится в космосе. Вселенная, в свою очередь, является огромнейшим замкнутым пространством, в рамках которого происходят макроскопические процессы. В силу того, что в замкнутой системе энтропия постоянно увеличивает свой показатель, наш мир близится к тому, что скоро в нем мера хаоса достигнет бесконечной величины. Это значит, что все процессы попросту прекратятся за счет того, что энергия исчерпает себя. Такая критическая точка, которой мы достигнем, возможно, в неком будущем, получила название тепловой смерти. Получается, что все наши действия (движения, ходьба, бег), все явления, которые происходят на планете (дуновение ветра, цунами, движения литосферных плит), - все это вызывает необратимое увеличение энтропии и исчерпывает энергию.
Опровержение теории
Судить обо всем космосе человек до сих пор не может. Мы видим лишь часть мира, в котором живем, и исследуем этот уголок, доказывая определенные законы и формируя на основе этого свои представления. Потому первое опровержение возможности тепловой смерти, которая основана на втором законе термодинамики, заключается в том, что Вселенная может и не быть замкнутой системой. Доподлинно известно, что 85 процентов космоса состоит из антиматерии, свойства которой никому неизвестны. Второе опровержение заключается в том, что наш космос, даже если и замкнут, является сплошной флуктуацией. Из-за различных колебаний и смен размеров, масс, показателей энергии и температуры энтропия не увеличивается (в суммарном, вселенском значении) и не уменьшается. Следовательно, мы и так пребываем в состоянии термодинамического равновесия, или же, словами Клаузиса, в состоянии тепловой смерти.
Подводим итоги
Второй закон термодинамики неразрывно связан с развитием точных наук. Он был открыт на заре научно-технического прогресса и стал, можно сказать, отправной точкой для дальнейших работ ученых в области математики, физики и астрономии. Стоит отметить, что все это мы представляем сугубо в земных условиях. Вполне вероятно, что в другой среде, где гравитационные поля имеют иную силу, термодинамика будет работать по совсем другой схеме.
Второй закон термодинамики. Энтропия.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики:
Кельвина и Планка
- Клаузиуса
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S) .
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
- 100% энергии не может быть преобразовано в работу
- Энтропия может вырабатываться, но не может быть уничтожена
Эффективность теплового двигателя
Эффективность теплового двигателя, действующего между двумя энергетическими уровнями, определена в пересчете на абсолютные температуры
η = (T h - T c) / T h = 1 - T c / T h
η = эффективность
T c = нижняя граница температуры (K)
Для того, чтобы достичь максимальной эффективности T c должна быть на столько низкой, на сколько это возможно. Чтобы эффект был 100% -м, T c должна равнятся 0 по шкале Kельвина. Практически это невозможно, поэтому эффективность всегда меньше 1 (менее 100%).
- Изменение энтропии > 0
Необратимый процесс - Изменение энтропии= 0
Двусторонний процесс (обратимый) - Изменение энтропии < 0
Невозможный процесс (неосуществимый)
Энтропия определяет относительную способность одной системы влиять на другую. Когда энергия двигается к нижнему энергетическому уровню, где уменьшается возможность влияния на окружающую среду, энтропия увеличивается.
Определение энтропии
Энтропия определяется как:
T = абсолютная температура (K)
Изменение энтропии системы вызвано изменением содержания темпла в ней. Изменение энтропии равно изменению темпла системы деленной на среднюю абсолютную температуру (T a):
Сумма значений (H / T) для каждого полного цикла Карно равна 0. Это происходит из-за того, что каждому положительному H противостоит отрицательное значение H.
- Тепловой цикл Карно
Цикл Карно— идеальный термодинамический цикл.
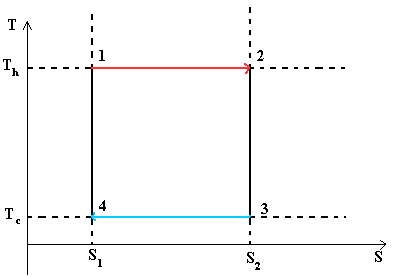
В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 --() --> Положение 2 --() --> Положение 3 --(изотермическое сжатие) --> Положение 4 --(адиабатическое сжатие) --> Положение 1
Положение 1 - Положение 2: Изотермическое расширение
Изотермическое расширение. В начале процесса рабочее тело имеет температуру T h , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q H . При этом объём рабочего тела увеличивается. Q H =∫Tds=T h (S 2 -S 1) =T h ΔS
Положение 2 - Положение 3: Адиабатическое расширение
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Положение 3 - Положение 4: Изотермическое сжатие
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру T c , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Q c . Q c =T c (S 2 -S 1)=T c ΔS
Положение 4 - Положение 1: Адиабатическое сжатие
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Законы термодинамики были определены эмперическим путем (эксперементально). Второй закон термодинамики - это обощение экспериментов, связанных с энтропией. Известно, что dS системы плюс dS окружающей среды равно или больше 0.
- Энтропия адиабатически изолированной системы не меняется!
Пример - Энтропия при нагревании воды
Процесс нагревания 1 кг воды от 0 до 100 o C (273 до 373 K)
При 0 o C = 0 кДж/кг (удельная - на единицу массы)
При 100 o C = 419 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= ((419 кДж/кг) - (0 кДж/кг)) / ((273 К + 373 К)/2)
= 1.297 кДж/кг*К
Пример - Энтропия при испарении воды
Процесс превращения 1 кг воды при 100 o C (373 K) в насыщенный пар при 100 o C (373 K) при нормальных условиях.
Удельная энтальпия пара при 100 o C (373 K) до испарения = 0 кДж/кг
100 o C (373 K) при испарении = 2 258 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды - это сумма удельной энтропии воды (при 0 o C) плюс удельная энтропия пара (при температуре 100 o C).
Как известно, первое начало термодинамики отображает закон сохранения энергии в термодинамических процессах, однако оно не дает представление о направлении протекания процессов. Помимо этого можно придумать множество термодинамических процессов, которые не будут противоречить первому началу, но в реальной действительности таких процессов не существует. Существование второго закона (начала) термодинамики вызвано необходимостью установить возможность того или иного процесса. Этот закон определяет направление течения термодинамических процессов. При формулировке второго начала термодинамики используют понятия энтропии и неравенство Клаузиуса. В таком случае второй закон термодинамики формулируется как закон роста энтропии замкнутой системы, если процесс является необратимым.
Формулировки второго закона термодинамики
Если в замкнутой системе происходит процесс, то энтропия этой системы не убывает. В виде формулы второй закон термодинамики записывают как:
где S - энтропия; L - путь по которому система переходит из одного состояния в другое.
В данной формулировке второго начала термодинамики следует обратить внимание на то, что рассматриваемая система должна быть замкнутой. В незамкнутой системе энтропия может вести себя как угодно (и убывать, и возрастать, и оставаться постоянной). Заметим, что энтропия не изменяется в замкнутой системе при обратимых процессах.
Рост энтропии в замкнутой системе при необратимых процессах — это переход термодинамической системы из состояний с меньшей вероятностью в состояния с большей вероятностью. Известная формула Больцмана дает статистическое толкование второго закона термодинамики:
где k - постоянная Больцмана; w - термодинамическая вероятность (количество способов при помощи которых, может реализовываться рассматриваемое макросостояние системы). Так, второй закон термодинамики является статистическим законом, который связан с описанием закономерностей теплового (хаотического) движения молекул, которые составляют термодинамическую систему.
Другие формулировки второго закона термодинамики
Существует ряд других формулировок второго закона термодинамики:
1) Формулировка Кельвина: Невозможно создать круговой процесс, результатом которого станет исключительно превращение теплоты, которое получено от нагревателя, в работу. Из данной формулировки второго закона термодинамики делают вывод о невозможности создания вечного двигателя второго рода. Это означает, что периодически действующая тепловая машина должна иметь нагреватель, рабочее тело и холодильник. При этом КПД идеальной тепловой машины не может быть больше, чем КПД цикла Карно:
![]()
где - температура нагревателя; — температура холодильника; ( title="Rendered by QuickLaTeX.com" height="15" width="65" style="vertical-align: -3px;">).
2) Формулировка Клаузиуса: Невозможно создать круговой процесс в результате которого будет происходить исключительно передача тепла от тела с меньшей температурой к телу с большей температурой.
Второй закон термодинамики отмечает существенное различие между двумя формами передачи энергии (работой и теплотой). Из этого закона следует, переход упорядоченного перемещение тела, как единого целого в хаотическое движение молекул тела и внешней среды - является необратимым процессом. При этом упорядоченное движение может переходить в хаотическое без дополнительных (компенсационных) процессов. Тогда как переход неупорядоченного движения в упорядоченное должен сопровождаться компенсирующим процессом.
Примеры решения задач
ПРИМЕР 1
| Задание | В чем состоит суть проблемы «Тепловой смерти Вселенной»? Почему эта проблема является несостоятельной? |
| Решение | Данная проблема была сформулирована в XIX веке. Если считать Вселенную замкнутой системой и пытаться применить к ней второй закон термодинамики, то по гипотезе Клаузиуса энтропия Вселенной достигнет некоторого максимума. То есть через некоторое время все формы движения станут тепловым движением. Вся теплота от тел с более высокой температурой перейдет к телам, имеющим более низкую температуру, то есть температуры всех тел Вселенной станут равны. Вселенная придет в состояние теплового равновесия, все процессы прекратятся — это называют тепловой смертью Вселенной. Ошибка данного положения о тепловой смерти Вселенной заключена в том, что второй закон термодинамики неприменим к незамкнутым системам, а Вселенную считать замкнутой не следует. Так как она является безграничной и состоит в бесконечном развитии. |
ПРИМЕР 2
| Задание | Чему равно КПД цикла, который представлен на рис.1? Считайте, что в процессе участвует идеальный газ (число степеней свободы равно i) и его объем изменяется в n раз.
|
| Решение | Коэффициент полезного действия цикла, который представлен на рис.1 найдем как:
где — количество теплоты, которое рабочее тело получает от нагревателя в представленном цикле. В адиабатных процессах подвода и отвода тепла нет, получается, что тепло подводится только в процессе 1-2. — количество теплоты, которое отводится от газа в процессе 3-4. Используя первое начало термодинамики, найдем количество тепла, полученное газом в процессе 1-2, который является изохорным: так как изменения объема в данном процессе нет. Изменение внутренней энергии газа определим как:По аналогии для изохорного процесса, в котором теплота отводится, имеем: Подставим полученный результат (2.2 - 2.5) в выражение (2.1): Используем уравнение адиабаты для нахождения разностей температур, и рассматривая рис.1. Для процесса 2-3 запишем: |
Один из основных законов физики, закон о неубывания энтропии в изолированной системе.
Для системы с постоянной температурой существует определенная функция состояния S - энтропия, которая определяется таким образом, что
1. Адиабатический переход из равновесного состояния A в равновесное состояние B возможен лишь тогда, когда
2. Прирост энтропии в медленном квазистатического процессе равно
Где T - температура.
Приведенное формулировка очень формаличне. Существует очень много альтернативных формулировок второго закона термодинамики. Например, Планк предложил следующую формулировку:
Невозможно построить машину, которая бы работала циклично, охлаждала бы источник тепла или поднимала вверх грузы, не вызывая
при этом никаких изменений в природе.
Константин Каратеодори дал аксиоматически строгое формулировки
Вблизи состояния 1 существуют такие состояния 2, адиабатические переходы от состояния 1 до состояния 2 невозможны.
Больцман сформулировал второй закон термодинамики с точки зрения статистической физики:
Природа стремится перейти из состояний с меньшей вероятностью реализации в состояния с большей вероятностью реализации.
Распространены такие формулировки.
Неможливо побудувати вічний двигун другого роду
.
Невозможно передать тепло от холодного тела к горячему, не затратив при этом энергию.
Каждая система стремится перейти от порядка к беспорядка.
Второй закон термодинамики был сформульваних в середине 19-го века, в те времена, когда создавалась теоретическая основа для конструирования и построения тепловых машин. Опыты Майера и Джоуля установили эквивалентность между тепловой и механической энергиями (первый закон термодинамики). Возник вопрос об эффективности тепловых машин. Экспериментальные исследования свидетельствовали о том, что часть тепла обязательно теряется при работе любой машины.
В 1850-х, 1860-х годах Клаузиус в ряде публикаций разработал понятие энтропии. В 1865 году он наконец выбрал для нового понятия имя. Эти публикации доказали также, что тепло невозможно полностью преобразовать в полезную работу, сформулировав таким образом второй закон термодинамики.
Статистическую интерпретацию второму закону термодинамики дал Больцман, введя новое определение для энтропии, которое базировалось на микроскопических атомистических представлениях.
Статистическая физика вводит новое определение энтропии, на первый взгляд очень отличное от определения термодинамики. Оно задается формулой Больцмана:
Где? - количество микроскопических состояний, соответствующих данному макроскопическому состояния, k B
- постоянная Больцмана.
Из статистического определения энтропии очевидно, что рост энтропии соответствует переходу к такому макроскопического состояния, которое характеризуется наибольшим значением микроскопических состояний.
Если исходное состояние термодинамической системы неравновесное, то со временем она переходит к равновесному состоянию, увеличивая свою энтропию. Этот процесс протекает только в одну сторону. Обратный процесс - переход от равновесного состояния к начальному неравновесного, не реализуется. То есть, течение времени получает направление.
Законы физики, описывающие микроскопический мир, инвариантные относительно замены t на-t. Данное утверждение справедливо как в отношении законов классической механики, так и законов квантовой механики. В микроскопическом мире действуют консервативные силы, нет трения, которое является диссипацией энергии, т.е. преобразованием других видов энергии в энергию теплового движения, а это в свою очередь связано с законом неубывания энтропии.
Представим себе, например, газ в резервуаре, помещенном в больший резервуар. Если открыть клапан меньшего резервуара, то газ через некоторое время заполнит больший резервуар таким образом, что его плотность выровняется. Согласно законам микроскопического мира, существует также и обратный процесс, когда газ из большего резервуара соберется в меньшую емкость. Но в макроскопическом мире такое никогда не реализуется.
Если энтропия каждой изолированной системе только увеличивается со временем, а Вселенная является изолированной системой, то когда-нибудь энтропия достигнет максимума, после чего любые изменения в нем станут невозможными.
Такие соображения, которые появились после установки второго закона термодинамики, получившие название тепловой смерти.
Эта гипотеза широко дискутировалась в 19-ом столетии.
Каждый процесс в мире приводит к рассеянию части энергии и перехода ее в тепло, ко все большему беспорядка. Конечно, наша Вселенная еще достаточно молод. Термоядерные процессы в звездах приводят к устойчивому потока энергии на Землю, например. Земля есть и еще долго будет оставаться открытой системой, которая получает энергию из различных источников: от Солнца, от процессов радиоактивного распада в ядре, т. В открытых системах, энтропия может уменьшаться, что приводит к появлению разнообразных благоустроенных стуктур.






