Как известно, первое начало термодинамики отображает закон сохранения энергии в термодинамических процессах, однако оно не дает представление о направлении протекания процессов. Помимо этого можно придумать множество термодинамических процессов, которые не будут противоречить первому началу, но в реальной действительности таких процессов не существует. Существование второго закона (начала) термодинамики вызвано необходимостью установить возможность того или иного процесса. Этот закон определяет направление течения термодинамических процессов. При формулировке второго начала термодинамики используют понятия энтропии и неравенство Клаузиуса. В таком случае второй закон термодинамики формулируется как закон роста энтропии замкнутой системы, если процесс является необратимым.
Формулировки второго закона термодинамики
Если в замкнутой системе происходит процесс, то энтропия этой системы не убывает. В виде формулы второй закон термодинамики записывают как:
где S - энтропия; L - путь по которому система переходит из одного состояния в другое.
В данной формулировке второго начала термодинамики следует обратить внимание на то, что рассматриваемая система должна быть замкнутой. В незамкнутой системе энтропия может вести себя как угодно (и убывать, и возрастать, и оставаться постоянной). Заметим, что энтропия не изменяется в замкнутой системе при обратимых процессах.
Рост энтропии в замкнутой системе при необратимых процессах — это переход термодинамической системы из состояний с меньшей вероятностью в состояния с большей вероятностью. Известная формула Больцмана дает статистическое толкование второго закона термодинамики:
где k - постоянная Больцмана; w - термодинамическая вероятность (количество способов при помощи которых, может реализовываться рассматриваемое макросостояние системы). Так, второй закон термодинамики является статистическим законом, который связан с описанием закономерностей теплового (хаотического) движения молекул, которые составляют термодинамическую систему.
Другие формулировки второго закона термодинамики
Существует ряд других формулировок второго закона термодинамики:
1) Формулировка Кельвина: Невозможно создать круговой процесс, результатом которого станет исключительно превращение теплоты, которое получено от нагревателя, в работу. Из данной формулировки второго закона термодинамики делают вывод о невозможности создания вечного двигателя второго рода. Это означает, что периодически действующая тепловая машина должна иметь нагреватель, рабочее тело и холодильник. При этом КПД идеальной тепловой машины не может быть больше, чем КПД цикла Карно:
![]()
где - температура нагревателя; — температура холодильника; ( title="Rendered by QuickLaTeX.com" height="15" width="65" style="vertical-align: -3px;">).
2) Формулировка Клаузиуса: Невозможно создать круговой процесс в результате которого будет происходить исключительно передача тепла от тела с меньшей температурой к телу с большей температурой.
Второй закон термодинамики отмечает существенное различие между двумя формами передачи энергии (работой и теплотой). Из этого закона следует, переход упорядоченного перемещение тела, как единого целого в хаотическое движение молекул тела и внешней среды - является необратимым процессом. При этом упорядоченное движение может переходить в хаотическое без дополнительных (компенсационных) процессов. Тогда как переход неупорядоченного движения в упорядоченное должен сопровождаться компенсирующим процессом.
Примеры решения задач
ПРИМЕР 1
| Задание | В чем состоит суть проблемы «Тепловой смерти Вселенной»? Почему эта проблема является несостоятельной? |
| Решение | Данная проблема была сформулирована в XIX веке. Если считать Вселенную замкнутой системой и пытаться применить к ней второй закон термодинамики, то по гипотезе Клаузиуса энтропия Вселенной достигнет некоторого максимума. То есть через некоторое время все формы движения станут тепловым движением. Вся теплота от тел с более высокой температурой перейдет к телам, имеющим более низкую температуру, то есть температуры всех тел Вселенной станут равны. Вселенная придет в состояние теплового равновесия, все процессы прекратятся — это называют тепловой смертью Вселенной. Ошибка данного положения о тепловой смерти Вселенной заключена в том, что второй закон термодинамики неприменим к незамкнутым системам, а Вселенную считать замкнутой не следует. Так как она является безграничной и состоит в бесконечном развитии. |
ПРИМЕР 2
| Задание | Чему равно КПД цикла, который представлен на рис.1? Считайте, что в процессе участвует идеальный газ (число степеней свободы равно i) и его объем изменяется в n раз.
|
| Решение | Коэффициент полезного действия цикла, который представлен на рис.1 найдем как:
где — количество теплоты, которое рабочее тело получает от нагревателя в представленном цикле. В адиабатных процессах подвода и отвода тепла нет, получается, что тепло подводится только в процессе 1-2. — количество теплоты, которое отводится от газа в процессе 3-4. Используя первое начало термодинамики, найдем количество тепла, полученное газом в процессе 1-2, который является изохорным: так как изменения объема в данном процессе нет. Изменение внутренней энергии газа определим как:По аналогии для изохорного процесса, в котором теплота отводится, имеем: Подставим полученный результат (2.2 - 2.5) в выражение (2.1): Используем уравнение адиабаты для нахождения разностей температур, и рассматривая рис.1. Для процесса 2-3 запишем: |
В физике, так как она является точной наукой, большинство догм доказывается эмпирическим путем. Именно таким образом был выведен второй закон термодинамики, который сегодня изучается в каждой школе. Необратимость тепловых процессов - вот о чем он говорит. Стоит отметить, что на начальных этапах изучения такая трактовка куда более понятна.
Общие представления
Физическим принципом, который ограничивает направления различных процессов в термодинамических системах, является второй закон термодинамики. Определение данного термина было сформировано в 19 столетии, сначала Рудольфом Клаузисом, а затем Уильямом Томсоном (лордом Кельвином). В соответствии с двумя постулатами в мире не может существовать некий вечный двигатель второго рода. Нет и не будет такой установки, которая бы тепло, исходящее от всех вещей, живых существ и явлений, превращала в энергию для своей постоянной работы. Исходя из этого было выведено правило, что КПД не может равняться единице. Сравнить это можно с работой холодильника, где температура, допустим, будет равна абсолютному нулю. В таких условиях круговой обмен теплом исключен.
Формулировка Рудольфа Клаузиса
Первым озвучил второй закон термодинамики Р. Клаузис - немецкий физик-практик и математик. По его словам, круговой процесс, в котором результат достигается путем передачи теплоты от менее нагретого тела к более нагретому, невозможен. Иными словами, температура в полной или частичной мере может свободно переходить от более теплого тела к более охлажденному, но в обратном направлении этот процесс происходить не сможет. Это наглядным образом демонстрирует нам отсутствие цикличности, замкнутого круга. Такие понятия неприемлемы для термодинамики. Между телами просто происходит обмен теплом, и в результате этих действий не производится лишняя энергия.

Постулат, выведенный лордом Кельвином
Аналогичное определение второй закон термодинамики получил в трудах Томсона - британского физика и механика. Теоретически он звучит так: «Циклический процесс, единственным результатом которого могла бы быть работа, получаемая путем охлаждения теплого тела или резервуара, невозможен». Чтобы понять более ясно такую трактовку, представим себе некую машину (в соответствии с термодинамическим постулатом она существовать не может). Она периодически охлаждает резервуар с постоянно горячей водой, получая от этого тепловую энергию. За счет этой энергии машина поднимает различные грузы, как строительный кран. При этом в ней нет мотора, силовых установок и прочего механического наполнения. В точки зрения эмпирической физики такое невозможно.

Что общего?
Теперь рассмотрим, каким образом эти две трактовки объединяются и на что в принципе опирается второй закон термодинамики. Энтропия - та самая мера хаоса, которая увеличивается в процессе обмена теплом. Именно она является связующим элементом для описания Клаузиса и Кельвина. Но вернемся немного назад. Второе начало термодинамики гласит, что при обмене теплом энергия убывает (потому получение работы никак не возможно), но при этом мера хаоса увеличивается. Этот процесс необратимый, и часто его называют стихийным. В термодинамике энтропия постоянно приумножается, но ее уничтожение невозможно. Именно поэтому даже 100 процентов энергии, которые находятся в любом теле, не могут преобразоваться в работу.

Что такое мера хаоса?
Само понятие энтропии впервые было сформулировано устами Клаузиса. Оно применялось для определения меры необратимого процесса рассеивания энергии. Это была своего рода разница отклонения реального процесса от идеального. Энтропия в замкнутых системах, где любые процессы происходят циклично, имеет постоянную величину. Если же процесс необратимый (что непосредственно касается термодинамики), то энтропия всегда имеет положительное значение. Также стоит выделить, что мера хаоса порождается абсолютно всеми процессами, которые происходят во Вселенной. При постоянных показателях объема и энергии какого-либо тела или резервуара энтропия постоянно возрастает. Если данные показатели периодически меняются, то мера хаоса может уменьшиться за счет производимой работы, но ее полное уничтожение невозможно. При этом стоит отметить, что энтропия Вселенной не уменьшается. Она остается либо в норме, либо безвозвратно увеличивается.

Наглядный пример
Второй закон термодинамики можно объяснить на стандартном примере, который часто приводят школьникам. У нас есть два тела с различной температурой. Более нагретая субстанция будет отдавать свое тепло менее нагретой до тех пор, пока их температурные показатели не сравняются. В ходе данного процесса энтропия у первого, более теплого тела уменьшится на меньший показатель, нежели она увеличится у второго, более прохладного тела. В результате подобный самопроизвольный процесс создаст энтропию системы, показатель которой будет выше, чем суммарное значение энтропий двух тел в первоначальном положении. Иными словами, мера хаоса системы двух субстанций, полученная в результате обмена теплом, увеличилась.

Тепловая смерть Вселенной
Проводя свои расследования, Клаузис пришел к выводу, что каким бы открытым нам ни казалось пространство (наша планета, ее отдельные территории, акватории и т.д.), все это находится в космосе. Вселенная, в свою очередь, является огромнейшим замкнутым пространством, в рамках которого происходят макроскопические процессы. В силу того, что в замкнутой системе энтропия постоянно увеличивает свой показатель, наш мир близится к тому, что скоро в нем мера хаоса достигнет бесконечной величины. Это значит, что все процессы попросту прекратятся за счет того, что энергия исчерпает себя. Такая критическая точка, которой мы достигнем, возможно, в неком будущем, получила название тепловой смерти. Получается, что все наши действия (движения, ходьба, бег), все явления, которые происходят на планете (дуновение ветра, цунами, движения литосферных плит), - все это вызывает необратимое увеличение энтропии и исчерпывает энергию.
Опровержение теории
Судить обо всем космосе человек до сих пор не может. Мы видим лишь часть мира, в котором живем, и исследуем этот уголок, доказывая определенные законы и формируя на основе этого свои представления. Потому первое опровержение возможности тепловой смерти, которая основана на втором законе термодинамики, заключается в том, что Вселенная может и не быть замкнутой системой. Доподлинно известно, что 85 процентов космоса состоит из антиматерии, свойства которой никому неизвестны. Второе опровержение заключается в том, что наш космос, даже если и замкнут, является сплошной флуктуацией. Из-за различных колебаний и смен размеров, масс, показателей энергии и температуры энтропия не увеличивается (в суммарном, вселенском значении) и не уменьшается. Следовательно, мы и так пребываем в состоянии термодинамического равновесия, или же, словами Клаузиса, в состоянии тепловой смерти.
Подводим итоги
Второй закон термодинамики неразрывно связан с развитием точных наук. Он был открыт на заре научно-технического прогресса и стал, можно сказать, отправной точкой для дальнейших работ ученых в области математики, физики и астрономии. Стоит отметить, что все это мы представляем сугубо в земных условиях. Вполне вероятно, что в другой среде, где гравитационные поля имеют иную силу, термодинамика будет работать по совсем другой схеме.
Второй закон термодинамики. Энтропия.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики:
Кельвина и Планка
- Клаузиуса
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S) .
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
- 100% энергии не может быть преобразовано в работу
- Энтропия может вырабатываться, но не может быть уничтожена
Эффективность теплового двигателя
Эффективность теплового двигателя, действующего между двумя энергетическими уровнями, определена в пересчете на абсолютные температуры
η = (T h - T c) / T h = 1 - T c / T h
η = эффективность
T c = нижняя граница температуры (K)
Для того, чтобы достичь максимальной эффективности T c должна быть на столько низкой, на сколько это возможно. Чтобы эффект был 100% -м, T c должна равнятся 0 по шкале Kельвина. Практически это невозможно, поэтому эффективность всегда меньше 1 (менее 100%).
- Изменение энтропии > 0
Необратимый процесс - Изменение энтропии= 0
Двусторонний процесс (обратимый) - Изменение энтропии < 0
Невозможный процесс (неосуществимый)
Энтропия определяет относительную способность одной системы влиять на другую. Когда энергия двигается к нижнему энергетическому уровню, где уменьшается возможность влияния на окружающую среду, энтропия увеличивается.
Определение энтропии
Энтропия определяется как:
T = абсолютная температура (K)
Изменение энтропии системы вызвано изменением содержания темпла в ней. Изменение энтропии равно изменению темпла системы деленной на среднюю абсолютную температуру (T a):
Сумма значений (H / T) для каждого полного цикла Карно равна 0. Это происходит из-за того, что каждому положительному H противостоит отрицательное значение H.
- Тепловой цикл Карно
Цикл Карно— идеальный термодинамический цикл.
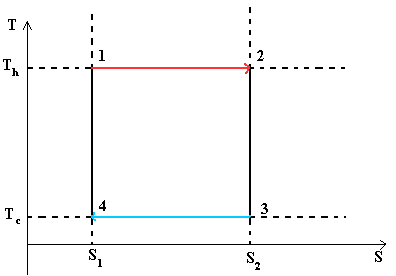
В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 --() --> Положение 2 --() --> Положение 3 --(изотермическое сжатие) --> Положение 4 --(адиабатическое сжатие) --> Положение 1
Положение 1 - Положение 2: Изотермическое расширение
Изотермическое расширение. В начале процесса рабочее тело имеет температуру T h , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q H . При этом объём рабочего тела увеличивается. Q H =∫Tds=T h (S 2 -S 1) =T h ΔS
Положение 2 - Положение 3: Адиабатическое расширение
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Положение 3 - Положение 4: Изотермическое сжатие
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру T c , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Q c . Q c =T c (S 2 -S 1)=T c ΔS
Положение 4 - Положение 1: Адиабатическое сжатие
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Законы термодинамики были определены эмперическим путем (эксперементально). Второй закон термодинамики - это обощение экспериментов, связанных с энтропией. Известно, что dS системы плюс dS окружающей среды равно или больше 0.
- Энтропия адиабатически изолированной системы не меняется!
Пример - Энтропия при нагревании воды
Процесс нагревания 1 кг воды от 0 до 100 o C (273 до 373 K)
При 0 o C = 0 кДж/кг (удельная - на единицу массы)
При 100 o C = 419 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= ((419 кДж/кг) - (0 кДж/кг)) / ((273 К + 373 К)/2)
= 1.297 кДж/кг*К
Пример - Энтропия при испарении воды
Процесс превращения 1 кг воды при 100 o C (373 K) в насыщенный пар при 100 o C (373 K) при нормальных условиях.
Удельная энтальпия пара при 100 o C (373 K) до испарения = 0 кДж/кг
100 o C (373 K) при испарении = 2 258 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды - это сумма удельной энтропии воды (при 0 o C) плюс удельная энтропия пара (при температуре 100 o C).
Энтропия. Второй закон термодинамики
Самопроизвольные процессы. В природе физические и химические превращения совершаются в определенном направлении. Так, два тела, находящиеся при разных температурах, вступают в контакт, тепловая энергия передается от более теплого тела к более холодному до тех пор, пока температура этих двух тел не сравняется. При погружении цинковой пластинки в соляную кислоту образуется ZnCl 2 и H 2 . Все эти превращения являются самопроизвольными (спонтанными ). Самопроизвольный процесс не может протекать в обратном направлении так же самопроизвольно, как в прямом.
В химии важно знать критерии, позволяющие предвидеть, может ли химическая реакция происходить самопроизвольно, и если может, то уметь определить количества образовавшихся продуктов. Первый закон термодинамики такого критерия не дает. Тепловой эффект реакции не определяет направления процесса. Самопроизвольно могут протекать как экзотермические, так и эндотермические реакции. Так, например, самопроизвольно идет процесс растворения нитрата аммония NH 4 NO 3 (к) в воде, хотя тепловой эффект этого процесса положителен: > 0 (процесс эндотермический); тоже самое можно сказать и о растворении гипосульфита натрия в воде. А в другом примере невозможно осуществить при Т = 298 К и p = 101 кПа (1 атм) синтез н. гептана C 7 H 16 (ж) , несмотря на то, что стандартная теплота его образования отрицательна: < 0 (процесс экзотермический).
Таким образом, разность энтальпий реакции еще не определяет возможности ее протекания в данных конкретных условиях.
Второй закон термодинамики. Критерий самопроизвольного протекания процесса в изолированных системах дает второй закон термодинамики.
Второй закон термодинамики дает возможность разделить все допускаемые первым законом процессы на самопроизвольные и не самопроизвольные.
Второй закон термодинамики является постулатом, обоснованным большим опытом, накопленным человечеством. Он выражается разными эквивалентными формулировками:
1. Теплота не может переходить сама собой от менее нагретого тела к более нагретому - постулат Клаузиуса (1850 г). Утверждается, что процесс теплопроводности необратим.
2. Быстро или медленно всякая система стремится к состоянию истинного равновесия.
3. Невозможен периодический процесс, единственным результатом которого является превращение теплоты в работу - формулировка Кельвина - Планк.
4. Теплота может переходить в работу только при наличии разности температур и не целиком, а с определенным термическим коэффициентом полезного действия:
![]()
где η - термический коэффициент полезного действия; A – работа, полученная системой за счет перехода тепла от тела с высокой температурой (T 1 ) к телу с низкой температурой (T 2 ); Q 1 – теплота, взятая у тела нагретого с температурой T 1 ; Q 2 – теплота, отданная холодному телу с температурой T 2 . Т.е. любые процессы протекают под действием разности потенциалов, каковой для тепловых процессов является разность температур, для электрических разность потенциалов, для механических - разность высот и т.д. Общим является сравнительно низкий коэффициент полезного действия. Значение к. п. д. обращается в единицу, если T 2 → 0 , но абсолютный нуль недостижим (третье начало термодинамики), следовательно, всю энергию нагретого тела при T 1 в работу превратить нельзя. Т.е. при совершении работы часть общей энергии системы остается неиспользованной.
Понятие об энтропии. Исследуя выражение к.п.д. тепловой машины Клаузиус ввел новую термодинамическую функцию, которую назвал энтропией – S .
Работа идеальной тепловой машины (цикл Карно) подробно рассматривается в курсе физики.
Из математического выражения второго закона термодинамики следует:
![]() или
или ![]()
В дифференциальной форме:
![]()
Суммируя изменения по всему циклу тепловой машины, получаем выражение где dQ – приращение тепла, T – соответствующая температура; - интеграл по замкнутому контуру.
Подинтегральное выражение Клаузиус принял за приращение новой функции S – энтропии:
или
Энтропия представляет собой функцию параметров состояния системы (p, V, T) и может оценить направление процесса в системе, стремящейся к равновесию, т.к. для равновесного процесса ее изменение равно нулю; или .
В случае необратимого превращения, т.е. спонтанного процесса, идущего при постоянной температуре, имеем
Если протекает процесс самопроизвольно, то изменение энтропии положительно:
Для изолированных систем процессы, для которых изменение энтропии < 0 , запрещены.
Если в качестве изолированной системы выбрать вселенную, то второе начало термодинамики можно сформулировать следующим образом:
Существует функция S, называемая энтропией, которая является такой функцией состояния, что
В случае обратимого процесса энтропия вселенной постоянна, а в случае необратимого процесса возрастает. Энтропия вселенной не может уменьшаться”.
Статистическая интерпретация энтропии. Для характеристики состояния некоторой массы вещества, являющейся совокупностью очень большого числа молекул можно указать параметры состояния системы и таким образом охарактеризовать макросостояние системы; но можно указать мгновенные координаты каждой молекулы (x i , y i , z i) и скорости перемещения по всем трем направлениям Vx i , Vy i , Vz i , т.е. охарактеризовать микросостояние системы. Каждому макросостоянию отвечает огромное число микросостояний. Число микросостояний, соответствующее макроскопическому состоянию определяется точными величинами параметров состояния и обозначается через W - термодинамическая вероятность состояния системы.
Термодинамическая вероятность состояния системы, состоящей всего из 10 молекул газа примерно 1000, а ведь только в 1 см 3 газа содержится 2,7 ∙ 10 19 молекул (н.у.). Поэтому в термодинамике используют не величину W , а ее логарифм lnW . Последнему можно придать размерность (Дж/К) , умножив на константу Больцмана К :
W , где =1, 38 · 10 -23 Дж/К,
где N A – число Авогадро
Величину S называют энтропией системы. Энтропия – термодинамическая функция состояния системы.
Если изолированная система находится в макроскопическом состоянии 1 , соответствующем W 1 микроскопических состояний и если она может перейти в макроскопическое состояние 2 , число микроскопических состояний которого W 2 , то система будет иметь тенденцию перейти в состояние 2 при условии, что W 2 > W 1
Система спонтанно стремится к состоянию, которому в микроскопическом масштабе соответствует наибольшее число возможностей реализации.
Например, при расширении идеального газа в пустоту конечное состояние (с большим объемом по сравнению с начальным состоянием) включает гораздо большее число микросостояний просто потому, что молекулы могут принимать большее число положений в пространстве.
Когда в изолированной системе происходит самопроизвольный процесс, число микроскопических состояний W возрастает; тоже самое можно сказать об энтропии системы. При возрастании числа микроскопических состояний W , связанных с макроскопическим состоянием системы, энтропия увеличивается.
Например, рассмотрим термодинамическое состояние 1 моль воды (18 г H 2 O ) при стандартных условиях. Пусть W (ж) - термодинамическая вероятность состояния этой системы. При понижении температуры до 0 ºС вода замерзает, превращается в лед; при этом молекулы воды как бы закрепляются в узлах кристаллической решетки и термодинамическая вероятность состояния системы уменьшается; W (к) < W (ж). Следовательно, падает и энтропия системы: (к) < (ж). Наоборот при повышении температуры до 100º С вода закипает и превращается в пар; при этом термодинамическая вероятность состояния системы увеличивается: W (г) > W (ж) , следовательно, растет и энтропия системы:
(г) > (ж).
Энтропия, таким образом, является мерой неупорядоченности состояния системы. Действительно, единственному микроскопическому состоянию (W = 1 ) будет соответствовать полная упорядоченность и нулевая энтропия, т.е. известны положение, скорость, энергия каждой частицы, и все эти микроскопические характеристики будут оставаться постоянными во времени.
Второй закон термодинамики можно сформулировать следующим образом:
Изолированная система стремится достигнуть наиболее вероятного состояния, т.е. макроскопического состояния, соответствующего наибольшему числу микроскопических состояний.
В изолированных системах самопроизвольно идут только те процессы, которые сопровождаются ростом энтропии системы: Δ S > 0 (Δ S = S 2 – S 1).
Энтропия чистых веществ, существующих в виде идеальных кристаллов при температуре абсолютного нуля равна нулю. Это значит, что при абсолютном нуле достигается полная упорядоченность.
Первый закон термодинамики представляет собой закон сохранения энергии применительно к термодинамическим процессам: энергия не исчезает в никуда и не возникает из ничего, а лишь переходит из одного вида в другой в эквивалентных количествах. Примером может послужить переход теплоты (тепловой энергии) в механическую энергию, и наоборот.
Если к М
кг газа, занимающего объем V
(м 3)
при температуре Т
подвести при постоянном давлении некоторое количество теплоты dQ
, то в результате этого температура газа повысится на dT
, а объем – на dV
. Повышение температуры связано с увеличением кинетической энергии движения молекул dK
.
Увеличение объема сопровождается увеличением расстояния между молекулами и, как следствие, уменьшением потенциальной энергии dH
взаимодействия между ними. Кроме того, увеличив объем, газ совершает работу dA
по преодолению внешних сил.
Если, кроме указанных, никаких иных процессов в рабочем теле не происходит, то на основании закона сохранения энергии можно записать:
dQ = dK + dH + dA .
Сумма dK + dH
представляет собой изменение внутренней энергии dU
молекул системы в результате подвода теплоты.
Тогда формулу сохранения энергии для термодинамического процесса можно записать в виде:
dQ = dU + dA или dQ = dU + pdV .
Это уравнение представляет собой математическое выражение первого закона термодинамики : количество теплоты dQ , подводимое к системе газа, затрачивается на изменение ее внутренней энергии dU и совершение внешней работы dA .
Условно считают, что при dQ > 0 теплота сообщается рабочему телу, а при dQ < 0 теплота отнимается от тела. При dA > 0 система совершает работу (газ расширяется) , а при dA < 0 работа совершается над системой (газ сжимается) .
Для идеального газа, между молекулами которого нет взаимодействия, изменение внутренней энергии dU полностью определяется изменением кинетической энергии движения (т. е. увеличением скорости молекул) , а изменение объема характеризует работу газа по преодолению внешних сил.
Первый закон термодинамики имеет еще одну формулировку: энергия изолированной термодинамической системы остается неизменной независимо от того, какие процессы в ней протекают
.
Невозможно построить вечный двигатель первого рода, т. е. периодически действующую машину, которая совершала бы работу без затраты энергии.
Второй закон термодинамики
Первый закон термодинамики описывает количественные соотношения между параметрами термодинамической системы, имеющими место в процессах преобразования тепловой энергии в механическую и наоборот, но не устанавливает условия, при которых эти процессы возможны. Эти условия, необходимые для преобразования одного вида энергии в другой, раскрывает второй закон термодинамики.
Существует несколько формулировок этого закона, и каждая из них имеет одинаковое смысловое содержание. Здесь приведены наиболее часто упоминающиеся формулировки второго закона термодинамики.
1. Для превращения теплоты в механическую работу необходимо иметь источник теплоты и холодильник, температура которого ниже температуры источника, т. е. необходим температурный перепад.
2. Нельзя осуществить тепловой двигатель, единственным результатом действия которого было бы превращение теплоты какого-либо тела в работу без того, чтобы часть теплоты не передавалась другим телам.
Из этой формулировки можно сделать вывод, что невозможно построить вечный двигатель, совершающий работу благодаря лишь одному источнику теплоты, поскольку любой, даже самый колоссальный источник теплоты в виде материального тела не способен отдать тепловой энергии больше, чем ему позволяет энтальпия (часть полной энергии тела, которую можно превратить в теплоту, охладив тело до температуры абсолютного нуля)
.
3. Теплота не может сама по себе переходить от менее нагретого тела к более нагретому без затраты внешней работы.
Как видите, второй закон термодинамики не имеет в своей основе формулярнго содержания, а лишь описывает условия, при которых возможны те или иные термодинамические явления и процессы, подтверждая, по сути, общий закон сохранения энергии.






