Закон энтропии
В восьмом принципе мы рассмотрим механизм уничтожения систем, неспособных эволюционировать. Этот механизм основан на возрастании энтропии вокруг развивающихся систем. Для того чтобы разобраться с действием этого механизма, необходимо отметить, что рассматривать его следует только в совместном взаимодействии системы и надсистемы, в терминах “внутренняя среда и окружающая среда”. Понятие внутренней среды системы вряд ли нуждается в какой-то конкретизации. А вот понятию окружающей среды нужно дать следующее определение. Под окружающей средой будем понимать совокупность всех взаимодействующих систем, входящих в надсистему. Поскольку система является частью будущей надсистемы, и занимает пространство, принадлежащее ей, то окружающая среда является внутренней средой самой надсистемы. Поэтому то, что происходит вокруг системы, совсем не безразлично для надсистемы, т.к. имеет непосредственное к ней отношение.
Интеграция системы адекватна понятию самоорганизации. Объединение системы со своим противоположным свойством переводит ее из неравновесного состояния в равновесное или из непроявленного состояния в проявленное.
Главной особенностью, которая отличает полученные холономные системы, является низкая энтропия внутренней среды. Понятие энтропии вводится только на эволюционном пути развития систем. По определению эволюционных процессов интеграция противоположностей в исходное целое сопровождается упорядочиванием внутренней структуры.
Мы уже установили, что для обеспечения энергетической стабильности в конструктивных процессах им сопутствуют некоторые дезорганизационные процессы. Поэтому проявленная необходимость обеспечения организации системы некой дезорганизацией и обусловлена в восьмом принципе. В принципе, тезис о том, что любое созидание оплачивается разрушением, отнюдь не нов. Но он станет более понятным, если сформулировать его в следующем виде: организация внутренней структуры системы сопровождается дезорганизацией внутренней структуры надсистемы, т.е. разрушением окружающей среды. Этот тезис подразумевает, что созидание первично и является причиной разрушения окружающей среды. Таким образом, причиной повышения энтропии окружающей среды является необратимость эволюционных процессов самоорганизации, которые сопровождаются понижением энтропии внутренней среды системы.
О том, что энтропия в природе все время возрастает, было установлено еще в 19 веке в виде знаменитого второго начала термодинамики. Чаще всего второе начало термодинамики звучит так: всякое изменение состояния системы самопроизвольно может происходить лишь в сторону увеличения энтропии. Открытие второго начала термодинамики привнесло в физическую науку представление об эволюции как о движении от абсолютной организованности к полному хаосу или полному рассеянию энергии во Вселенной.
Однажды в одной очень умной книге я прочитала, что американские студенты-физики, чтобы лучше помнить законы термодинамики, заучивают следующую фразу: «Если первый закон утверждает, что вы не можете выиграть, то второй закон говорит, что у вас даже нет шанса остаться при своих».
До сих пор энтропию мы рассматривали как количественную меру хаоса, не вводя никаких формул. Теперь на энтропию посмотрим с механистической точки зрения, воспользовавшись именно теми понятиями, которые с самого начали и ввели понятие энтропии в физику. Снова прибегнем к примеру с газовой системой. Вероятность события, при котором все молекулы газа соберутся случайным образом в одном месте, чрезвычайно мала. Логарифм этой вероятности и будем называть энтропией системы. Наибольшая вероятность для нашего газа, наблюдается в том случае, когда все молекулы равномерно распределены по всему объему системы. Но именно такое состояние и называется равновесным, значит, система находится в равновесии, когда энтропия максимальна. Понизим температуру нашего газа. Кинетическая энергия молекул уменьшается, начинают действовать межмолекулярные силы взаимодействия, молекулы объединяются, образуется твердое кристаллическое тело. В результате все молекулы собрались в одном месте. Порядок для такого состояния системы выше, чем у газа, значит, энтропия уменьшилась. Мы имеем два процесса: установление равновесия с повышением энтропии – первый, и преобразование тепловой энергии системы в какой-нибудь другой вид энергии с понижением энтропии – второй процесс. Переход из неравновесного состояния в равновесное состояние совершается произвольно, причем он может идти как с преобразованием, так и без преобразования тепловой энергии в другие виды энергии. А обратный процесс - процесс перехода систем из равновесного состояния в неравновесное состояние – самопроизвольно идти не может. В этом и заключен основной смысл второго начала термодинамики.
Но ведь мы на Земле и в космосе повсеместно наблюдаем обратную тенденцию, в биологических и социальных системах наблюдается именно преобразование хаоса в упорядоченные структуры.
Почему современная физика указывает только на фундаментальные законы, объясняющие причины деградационных или дезорганизационных процессов? Почему до сих пор не найден сравнимый по фундаментальности контрфактор, который позволил бы последовательно объяснить конструктивные феномены? Парадокс между биологическим эволюционизмом и термодинамической необратимостью остается до сих пор нерешенным, хотя ушли уже в историю попытки опровержения второго начала на чисто физической основе. Но все же большие трудности, которые возникают в области термодинамики и, особенно, в наиболее важных случаях открытых систем, включающих живое вещество, служит поводом к ограничению второго начала.
Причем фактические противоречия между реальными процессами самоорганизации систем и законом возрастания энтропии во внешней среде отсутствуют. Не обнаруживается нарушений термодинамических законов и в связи с активностью живых организмов, поскольку энтропия отходов всегда превышает энтропию поступающих веществ. Это свидетельствует в пользу того, что конструктивные феномены, определяющие внутреннюю самоорганизацию систем, опосредуются процессами рассеяния энергии в окружающей среде. Объяснить возникший парадокс между восходящими тенденциями эволюционного развития в биологии, обществоведении и нисходящим направлением эволюции, обусловленным вторым началом термодинамики, не возможно вне единства системы и надсистемы. Даже в самых простых формулировках, дающих определение понятию необратимых процессов, можно увидеть явное указание на этот факт: “необратимыми называются такие процессы, которые могут самопроизвольно протекать только в одном направлении; в обратном направлении они могут протекать только как одно из звеньев более сложного процесса”. Этот более сложный процесс, как правило, и связан с функциональными действиями надсистемы.
Таким образом, законы количественного изменения энтропии нужно рассматривать только на уровне взаимодействий системы и надсистемы. Если до сих пор наши основные принципы описывали иерархичность взаимоотношений, при которых только изменения в надсистеме вызывали соответствующие изменения в системе, то теперь появляется обратная связь, и изменения в системе также вызывают ответные реакции в надсистеме. Теперь любые процессы, происходящие в системе, будут иметь определенный отклик в надсистеме, что в основном объясняется нелокальностью интегральной структуры и целевой детерминацией внутренних процессов системы. Как видим, в этом случае еще лишний раз подтверждается, что сама интегральная структура мироздания играет в процессах эволюции главенствующую роль. И никакими другими факторами вы не сможете объяснить парадокс между восходящими тенденциями эволюционного развития в биологии, обществоведении и нисходящим направлением эволюции, обусловленным вторым началом термодинамики.
В этом случае второе начало можно рассматривать, как частный случай более общего закона, который гласит: процессы понижения энтропии внутренней среды и повышения энтропии окружающей среды, которые сопровождают самоорганизацию системы, взаимно дополняют, определяют и обусловливают друг друга. Этот закон в дальнейшем будем называть законом сохранения энтропии. Поскольку насколько уменьшится энтропия системы, настолько увеличится энтропия в надсистеме.
Другими словами закон энтропии можно сформулировать и так: понижение энтропии внутри системы при ее самоорганизации сопровождается повышением энтропии в окружающей среде. Обратное утверждение не верно, т.е. повышение энтропии в окружающей среде не ведет к понижению энтропии внутренней среды. В этом случае закон энтропии устанавливает прямую однозначную зависимость между причиной – самоорганизацией системы и следствием – изменением энтропии внутри и снаружи неравновесной системы. Вследствие необратимости эволюционных процессов из этого закона можно сделать еще один вывод: целенаправленное разрушение окружающей среды сопровождается разрушением внутренней структуры системы, вызвавшей это разрушение.
Механизм действия закона энтропии в данном случае сводится к следующему. Если система производит в окружающей среде какие-либо разрушительные действия, то со стороны надсистемы возникает ответная реакция, направленная на восстановление причиненного ущерба. Процесс восстановления, сопровождаемый теперь понижением энтропии в окружающей среде, должен быть оплачен принудительным повышением энтропии в системе, которая произвела эти разрушения. Поскольку здесь затронуты интересы надсистемы, предусматривающие сохранения ее целостности, то в самой системе через интегральную структуру включается механизм действия обратных связей в подсистеме, регулирующей функции контроля. Потому что именно здесь на этом уровне и происходит накопление той самой энтропии, которую произвела система. Причем как видно, количество ее будет удвоено за счет возвращения произведенной энтропии из внешней среды и за счет самого процесса возврата, который тоже самопроизвольно происходить не может, а только с повышение энтропии внутри системы. Управление включением подобного механизма обусловлено детерминизмом интегральной структуры и опосредствовано функцией целеполагания, которая в данном случае защищает интересы надсистемы.
Конструктивные феномены, определяющие внутреннюю самоорганизацию систем, описаны в 7 принципе. Каждая системная функция представляет собой антиэнтропийный фактор, который участвует в процессах самоорганизации систем.
Принято считать, что действие антиэнтропийных факторов заключается в том, чтобы только противостоять разрушающему влиянию окружающей среды. На самом деле структурообразующие функции, которые отвечают за внутреннюю организацию системы, являются основной причиной повышения энтропии в системе. А действие управляющих функций не только приспосабливает окружающую среду к собственным нуждам, но в основном направлено на уменьшение энтропии на своем контролирующем уровне. Поскольку большое количество накопленной энтропии здесь может привести систему к самоуничтожению. Такие процессы будут успешными только в том случае, если система постоянно способна уменьшать энтропию вокруг себя.
Таким образом, из закона энтропии можно сделать еще один вывод. Система будет уничтожена в любом случае, если она не способна к самоорганизации, к эволюционным преобразованиям с соблюдением основных ее критериев. Поэтому для системы есть единственный путь – эволюционный, это значит, что в этом мире невозможно выжить, если не двигаешься вверх, даже простая остановка в развитии может привести к уничтожению.
Девятый принцип
Мы уже говорили о том, что для полноценного развития систем возможность появления каких-то новых не запрограммированных возможностей принципиально важна. Интеграция исходной целостности с приобретением новых свойств есть одно из неоспоримых преимуществ такого типа эволюции. Поэтому в эволюционное развитие систем была введена случайная компонента, которая определяет порождение новых состояний.
В этом случае для большинства систем целевая причина эволюции обретает статус скрытого параметра, и свобода выбора теперь осуществляется в условиях неопределенного будущего. Поэтому на передний план в эволюционном развитии выступают внутренние побудительные мотивы системы, ее предшествующее состояние и характер взаимодействия с окружающей средой. Отсутствие конкретных знаний об эволюционной цели развития заменяется в данном случае вероятностным характером “попадания” в цель.
Таким образом, в девятом принципе закладывается вероятностно-статистический принцип детерминации. Возможность статистического способа достижения целей эволюции основывается на “трех китах”, во-первых, на бесконечном многообразии различных материальных форм, во-вторых, на возможности неоднократной попытки “попадания в цель”, в третьих, используется фактор самообучения систем, при котором каждое удачное “попадание в цель” поощряется, каждое неудачное - наказывается (по принципу действия обратных связей).
Рис.23. Усилитель отбора
Механизм действия такого способа достижения цели близок по описанию «усилителю отбора», предложенному У. Эшби еще в 50-х годах. Он назвал его усилителем мыслительных способностей. Схема показана на рисунке 23. Генератор шума поставляет «сырье» в первую ступень усилителя. Преобразователь шума 2 создает разные случайные варианты объектов отбора. В блоке 3 происходит отбор в соответствии с заложенными в устройство критериями отбора. Если результат отбора удовлетворяет критерию, срабатывает блок управления 4, открывая клапан 5 и пропуская отработанную информацию в преобразователь следующей ступени усилителя. Можно представить, что в первой ступени усилителя, куда поступают случайные буквы, происходит отбор отдельных случайно возникших слов или характерных слогов. Во второй ступени происходит отбор сочетаний слов, в третьей – отбор фраз и т.д. В процессе случайного поиска возникает как раз та информации, которая нужна системе для перевода ее в новое состояние. Этот процесс назван отбором информации из шума.
В эволюционном «усилителе отбора» роль «генератора шума», который поставляет «сырье» играет интегральная схема мироздания. Она устроена таким образом, что способна порождать бесконечно большое количество структурных форм в виде различных развивающихся систем. Роль усилителей первой, второй и т.д. ступеней играют системные функции седьмого принципа. Восьмой принцип в «усилителе отбора» не описан, но его принцип понять не сложно. В блоке 3 усилителя, в котором происходит отбор, только часть систем проходят в преобразователь следующей ступени. Большинство же систем остаются в блоке. Наступает момент, когда блок переполняется и требуется основательная его очистка. Вот тут и вступает в действие восьмой принцип, и все оставшиеся системы в блоке 3 уничтожаются.
Таким образом, первым условием 9 принципа является закон необходимого разнообразия, дающий возможность создания достаточно большого количества вариантов.
Второе условие 9 принципа – фактор самообучения систем. Основные эволюционные критерии для развивающихся систем не известны, но чтобы сократить время на поиск необходимой информации из шума, каждая ступень разбивается на ряд дополнительных уровней, на которых происходит закрепление полученных признаков. При этом каждое удачное случайно образованное сочетание поощряется, каждое неудачное наказывается.
Такой механизм можно обыграть на следующем примере. Стрелок стреляет по невидимой мишени, и где она находится ему не известно. Но каждый раз, когда попадает предельно близко к цели, он получает определенный положительный знак, но зато после этого, стреляя не в ту сторону, он получает отрицательные знаки. Поэтому третьим условием, хотя его можно назвать и вместо второго, это возможность пройти одну и туже ступень с нескольких попыток. Фактически давая возможность нашему стрелку сделать несколько выстрелов, мы тем самым значительно выигрываем во времени. В противном случае нам приходилось бы заменять каждый раз стрелка на нового, и его единственный случайный выстрел мог бы очень долгое время не давать никого результата.
49 ступеней развития планеты
Прогрессивная эволюция материи характеризуется тем, что в развитии планеты постепенно снизу вверх проявляются семь созидающих сил. Одну из этих сил, которая фактически сформировала окружающую физическую Вселенную в том виде, в каком мы ее знаем, мы уже рассмотрели. Эта сила, прообразом которой был исходный D-признак, завершив процесс холономной интеграции, полностью вошла всеми своими исходными компонентами в единую целостность, называемую Вселенной. Как было показано ранее, в этом процессе участвуют производные четвертого и более высоких порядков. Интеграция с субъектным свойством, определяемым как Природа, создало материальную Вселенную со всеми действующими в ней физическими законами, Солнечную систему, нашу планету, которая стала первым объектом, участвующим в дальнейшей эволюции. Можно считать, что Природа, как один из аспектов субъективной реальности, устанавливает созидающие силы, определяющие образование, развитие и длительное существование физической материи. Завершение интеграции на уровне производных четвертого порядка определило существование корпускулярной материи, которая продолжила дальнейший путь интеграции на уровне третьих производных.
Третьи частные производные были определены как основные антиэнтропийные функции F1 - F7, где к седьмой функции F7 как раз и относится образование физического тела планеты.
Интеграция с субъектными свойствами F6, F5, определяемых третьими производными субъективной реальности по U-признаку, дала возможность существованию всех живых существ. Это в свою очередь наделило эволюционирующий объект – планету двумя оболочками, представляющими растительный и животный мир, объединяемых термином биосфера. Биосфера, являясь мощной антиэнтропийной созидающей силой, преобразующей облик планеты, обозначила следующий очередной этап в эволюции планеты.
Этот следующий этап эволюции связан с интеграцией объекта - биосферы с субъектным свойством, определяемым по S-признаку, который в настоящий момент происходит на основе человека разумного (интеграция с F4).
Окончательная интеграция с последним аспектом субъективной реальности, происходящим также на уровне третьих частных производных (интеграция с F3, F2, F1), определит самую мощную и активную силу во Вселенной - силу сознания. Человек, обладающей подобной силой, по своим возможностям станет практически всемогущим.
Каждый из семи уровней творения, благодаря 8 и 9 принципу делятся еще на 7 подуровней, которые мы теперь будем называть ступенями. В результате этого, в процессе эволюции можно выделить 49 ступеней. Эволюционирующие системы, последовательно проходя все эти ступени, осваивают определенный набор функций, который присущ каждой из них. Поэтому, рассматривая ход эволюции Земли, мы будем последовательно разбирать процессы, происходящие на каждой из них.
Закон возрастания энтропии как одна из формулировок второго начала термодинамики
Рассмотрим замкнутую систему, которая переходит из состояния 1 в состояние 2 (рис.1) по пути $L_1$. Из состояния 2 в состояние 1 вернем систему с помощью обратимого процесса по пути $L_2$, но при этом мы понимаем, что система уже не является изолированной.
Так, мы получили цикл, к которому применимо неравенство Клаузиуса:
При переходе по пути $L_1$ система была изолированной, следовательно:
Переход 2-1 обратимый, следовательно, можно считать, что в этом процессе:
Иначе неравенство (4) запишем как:
Неравенство (5) означает, что при переходе замкнутой системы из состояния 1 в состояние 2 энтропия либо увеличивается, либо не изменяется. Закон возрастания энтропии (5) также относят к одной из формулировок второго начала термодинамики.
Возрастание и убывание энтропии
В процессах, которые протекают в изолированных системах, энтропия не убывает. В этом утверждении существенно то, что система должна быть изолирована. В неизолированных системах энтропия может и возрастать, и убывать и не изменяться. Энтропия не изменяется только в обратимых процессах. В необратимых процессах энтропия возрастает. Так как на практике процессы в системе, которая предоставлена самой себе, обычно необратимы, это значит, что энтропия изолированной системы обычно растет. Рост энтропии в изолированной системе означает, что система стремится к равновесному состоянию, которое является наиболее вероятным. Закон убывания энтропии в изолированной системе не запрещает полностью рост энтропии. Возможны отклонения, когда на каком-то отрезке времени система движется в направлении наименее вероятных состояний, то есть энтропия убывает или не меняется. И чем меньше система, тем роль таких флуктуаций больше. Однако для макросистем закон не убывания энтропии абсолютен.
Пример 1
Задание: Пусть имеется теплоизолированный сосуд, разделенный на две части перегородкой. Объемы частей $V_1$ и $V_2.$ В первой части находится ${\nu }_1$ молей идеального газа, во второй ${\nu }_2$ молей идеального газа. Температура в обеих частях сосуда одинакова и равна T. Перегородку убирают. Вычислите, как изменится энтропия газа ($\triangle S$) после установления равновесия.
Так как система считается теплоизолированной, газы идеальные, то внутренняя энергия таких газов зависит только от температуры и при смешении газов не изменяется. Заменим имеющийся в условиях задачи неравновесный процесс, равновесным в котором, каждая часть газа, расширяясь, занимает объем $V_1+V_2$. В таком случае для сконструированного нами обратимого процесса можно записать:
\[\triangle S=\int\limits^{(2)}_{(1)}{dS}=\int\limits^{V_1+V_2}_{V_1}{\frac{pdV}{T}}+\int\limits^{V_1+V_2}_{V_2}{\frac{pdV}{T}\left(1.1\right),}\]
Используем уравнение Менделеева -- Клайперона для идеального газа, выразим $\frac{p}{T}$, имеем:
\[\ pV=\nu RT\to \frac{\ p}{T}=\nu \frac{R}{V}\ \left(1.2\right),\]
Подставим (1.2) в (1.1), получим:
\[\triangle S=\int\limits^{V_1+V_2}_{V_1}{\frac{pdV}{T}}+\int\limits^{V_1+V_2}_{V_2}{\frac{pdV}{T}={\nu }_1R\int\limits^{V_1+V_2}_{V_1}{\frac{dV}{V}}+{\nu }_2R\int\limits^{V_1+V_2}_{V_2}{\frac{dV}{V}}={\nu }_1Rln\frac{V_1+V_2}{V_1}+{\nu }_2Rln\frac{V_1+V_2}{V_2}\left(1.3\right).}\]
Пример 2
Задание: Процесс расширения одноатомного идеального газа в количестве $\nu $ молей происходит так, что давление растет прямо пропорционально объему. Найти приращение энтропии газа, если объем в процессе увеличивается в а -- раз.
Процесс происходит с идеальным газом, следовательно, можем считать его обратимым и записать:
\[\triangle S=\int\limits^{\left(2\right)}_{\left(1\right)}{\frac{\delta Q}{T}\ \left(2.1\right).}\]
Из первого начала термодинамики мы знаем, что:
\[\delta Q=dU+pdV=\frac{i}{2}\nu RdT+pdV\left(2.2\right).\]
Подставим (2.2) в (2.1), получим:
\[\triangle S=\frac{i}{2}\nu R\int\limits^{T_2}_{T_1}{\frac{dT}{T}+\int\limits^{\left(2\right)}_{\left(1\right)}{\frac{pdV}{T}\left(2.3\right).}}\]
Запишем уравнение Менделеева -- Клайперона для того, чтобы выразить $\frac{p}{T},$ имеем:
Подставим (2.4) в (2.3), получим:
\[\triangle S=\frac{i}{2}\nu Rln\frac{T_2}{T_1}+\nu R\int\limits^{V_2}_{V_1}{\frac{dV}{V}=\frac{i}{2}нRln\frac{T_2}{T_1}+нRln\frac{V_2}{V_1}\left(2.5\right).}\]
Отношение объемов нам известно из условий задачи: $\frac{V_2}{V_1}=a.$ Выразим отношение температур. Используем для этого уравнение Менделеева - Клайперона и заданное в условиях задачи уравнение процесса ($p=bV$), где $b=const$:
\ \
Разделим (2.7) на (2.6) и используем уравнение процесса:
\[\frac{T_2}{T_1}=\frac{p_2V_2}{p_1V_1}\to \frac{T_2}{T_1}=\frac{b{V_2}^2}{b{V_1}^2}={\left(\frac{V_2}{V_1}\right)}^2\left(2.8\right).\]
Подставим (2.8) в (2.5), получим искомое изменение энтропии:
\[\triangle S=\frac{i}{2}\nu Rln{\left(\frac{V_2}{V_1}\right)}^2+\nu Rln\frac{V_2}{V_1}=i\nu Rln\left(a\right)+\nu Rln\left(a\right)=\nu Rln\left(a\right)\left(i+1\right)\left(2.7\right).\]
Ответ: Изменение энтропии в заданном процессе $\triangle S=\nu Rln\left(a\right)\left(i+1\right)$.
Второй закон термодинамики. Энтропия.
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики:
Кельвина и Планка
- Клаузиуса
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S) .
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
- 100% энергии не может быть преобразовано в работу
- Энтропия может вырабатываться, но не может быть уничтожена
Эффективность теплового двигателя
Эффективность теплового двигателя, действующего между двумя энергетическими уровнями, определена в пересчете на абсолютные температуры
η = (T h - T c) / T h = 1 - T c / T h
η = эффективность
T c = нижняя граница температуры (K)
Для того, чтобы достичь максимальной эффективности T c должна быть на столько низкой, на сколько это возможно. Чтобы эффект был 100% -м, T c должна равнятся 0 по шкале Kельвина. Практически это невозможно, поэтому эффективность всегда меньше 1 (менее 100%).
- Изменение энтропии > 0
Необратимый процесс - Изменение энтропии= 0
Двусторонний процесс (обратимый) - Изменение энтропии < 0
Невозможный процесс (неосуществимый)
Энтропия определяет относительную способность одной системы влиять на другую. Когда энергия двигается к нижнему энергетическому уровню, где уменьшается возможность влияния на окружающую среду, энтропия увеличивается.
Определение энтропии
Энтропия определяется как:
T = абсолютная температура (K)
Изменение энтропии системы вызвано изменением содержания темпла в ней. Изменение энтропии равно изменению темпла системы деленной на среднюю абсолютную температуру (T a):
Сумма значений (H / T) для каждого полного цикла Карно равна 0. Это происходит из-за того, что каждому положительному H противостоит отрицательное значение H.
- Тепловой цикл Карно
Цикл Карно— идеальный термодинамический цикл.
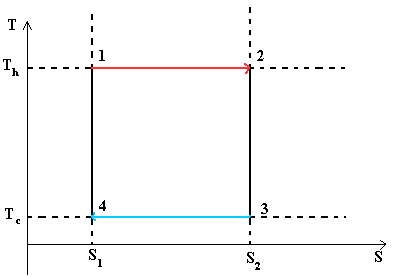
В тепловом двигателе, газ (реверсивно) нагревается (reversibly heated), а затем охлаждается. Модель цика следующая: Положение 1 --() --> Положение 2 --() --> Положение 3 --(изотермическое сжатие) --> Положение 4 --(адиабатическое сжатие) --> Положение 1
Положение 1 - Положение 2: Изотермическое расширение
Изотермическое расширение. В начале процесса рабочее тело имеет температуру T h , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Q H . При этом объём рабочего тела увеличивается. Q H =∫Tds=T h (S 2 -S 1) =T h ΔS
Положение 2 - Положение 3: Адиабатическое расширение
Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Положение 3 - Положение 4: Изотермическое сжатие
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру T c , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты Q c . Q c =T c (S 2 -S 1)=T c ΔS
Положение 4 - Положение 1: Адиабатическое сжатие
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
Законы термодинамики были определены эмперическим путем (эксперементально). Второй закон термодинамики - это обощение экспериментов, связанных с энтропией. Известно, что dS системы плюс dS окружающей среды равно или больше 0.
- Энтропия адиабатически изолированной системы не меняется!
Пример - Энтропия при нагревании воды
Процесс нагревания 1 кг воды от 0 до 100 o C (273 до 373 K)
При 0 o C = 0 кДж/кг (удельная - на единицу массы)
При 100 o C = 419 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= ((419 кДж/кг) - (0 кДж/кг)) / ((273 К + 373 К)/2)
= 1.297 кДж/кг*К
Пример - Энтропия при испарении воды
Процесс превращения 1 кг воды при 100 o C (373 K) в насыщенный пар при 100 o C (373 K) при нормальных условиях.
Удельная энтальпия пара при 100 o C (373 K) до испарения = 0 кДж/кг
100 o C (373 K) при испарении = 2 258 кДж/кг
Изменение удельной энтропии:
dS = dH / T a
= (2 258 - 0) / ((373 + 373)/2)
= 6.054 кДж/кг*К
Полное изменение удельной энтропии испарения воды - это сумма удельной энтропии воды (при 0 o C) плюс удельная энтропия пара (при температуре 100 o C).
Понятие «энтропия» ввел немецкий физик Рудольф Юлиус Эмануэль Клаузиус для обозначения тенденции вещей к и изнашиванию. В 1865 году он писал:
«Я предлагаю назвать величину S [энергию, которой не хватает для работы] энтропией тела, от греческого слова превращение... Энергия Вселенной постоянна - энтропия Вселенной стремится к максимуму «.
Люди стареют. Дома рушатся. Звезды сгорают. Утесы оседают в море.
Закон энтропии - это перефразировка первых двух законов термодинамики, сформулированных за несколько лет до 1850 года в процессе поиска способов усовершенствования паровых двигателей. Французский физик Никола Леонар Сади Карно обнаружил, что процесс потери тепла можно направить на выполнение какой-либо работы. Англичанин Джеймс Пре-скотт Джоуль открыл явление конверсии: при каком-либо действии выделяется дополнительное тепло.
Первое начало термодинамики, которое сформулировали независимо друг от друга Джоуль и немецкий естествоиспытатель Юлиус Роберт Майер, утверждает, что энергию нельзя ни создать, ни уничтожить - она может только менять свою форму. Затем в 1850 году Клаузиус, основываясь на работах Карно, дал определение второго начала термодинамики: любая химическая система, будь то твердое тело, жидкость или газ, стремится к максимальному беспорядку. Поток энергии движется только в одном направлении, к термическому равновесию. Тепло передается от одного тела другому, и этот переход необратим. Тепло можно использовать только один раз - оно перетекает в более холодное тело, и извлечь его оттуда невозможно (не добавляя еще больше энергии). Великий шотландский ученый Джеймс Клерк Максвелл (1831–1879) заметил по этому поводу:
«Если вы бросите в море бокал, полный воды, вы не сможете достать из воды тот же самый бокал».
У закона энтропии есть параллели с двумя биологическими концепциями, рассмотренными нами в части первой: эффектом черной королевы и эволюционной гонкой вооружений. Мир изменяется, и чтобы сохранить то, что у нас было раньше, мы должны сделать больше, чем сделали вчера. Вещи можно содержать в порядке или даже улучшить (краска на доме может выцвести, но дом можно покрасить снова еще лучше, чем раньше), но эта задача требует новых действий. Энергия системы разряжается и теряется, поэтому жизнь требует вливаний новой энергии.
Поддержание успеха требует постоянных усилий. Естественное состояние природы не равновесие, а энтропия. Конкурентное положение компании основывается на сложных взаимосвязях уникальных ресурсов и отношений, живых и беспокойных. Так же как любые системы и любые отношения, эти взаимосвязи, если о них не заботиться, не подкреплять и не обновлять, слабеют и распадаются. Противостоять энтропии вполне возможно (иначе как бы мы смогли накопить столько материальных ценностей за последние 250 лет?), но эта задача требует постоянных инноваций и улучшенного использования имеющейся в наличии энергии.
Закон возрастания энтропии
Замкнутые термодинамические системы, предоставленные самим себе, релаксируют к равновесному состоянию. При равновесии системы выполняется условие (¶r/¶t ) = 0. В этом случае функция распределения является интегралом движения, также как и гамильтониан. Функция распределения замкнутой системы может быть записана в виде
где W –число микросостояний, отвечающих данному макросостоянию. Энтропия в этом случае выражается формулой
Состояние статистического равновесия достигается замкнутой системой самопроизвольно, как результат движения и взаимодействия её составляющих частиц. Процесс перехода системы в равновесное состояние можно рассмотреть как последовательность ряда неравновесных макроскопических состояний с одинаковой энергией. При этом система последовательно переходит из менее вероятных в более вероятные состояния, т.е. последовательно возрастают статистический вес и энтропия системы. В равновесии энтропия системы достигает своего максимального значения. При этом внутреннее движение не прекращается, хотя макроскопическое состояние системы остаётся неизменным.
Итак, энтропия замкнутой системы не убывает – она возрастает или в предельном случае полного равновесия остается постоянной : .
Это утверждение называется законом возрастания энтропии . Смысл энтропии состоит в том, что она показывает степень неравновесности системы: отклонение от равновесия тем больше, чем меньше энтропия. Закон возрастания энтропии замкнутой системы задает направление времени или по определению Эддингтона «стрелу времени» в макропроцессах.
Закон возрастания энтропии соответствует второму закону термодинамики
Здесь Q – количество теплоты, полученной системой (для замкнутой системы Q = 0). С учетом первого закона термодинамики Q = DU + A получаем
где A – работа, совершаемая системой. Если процесс равновесный, т.е. система проходит через равновесные состояния в этом соотношении берется знак равенства.





