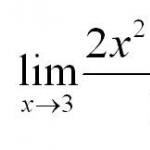Молекулярно-кинетическая теория - это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов, как мельчайших частиц вещества. В основе МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Основные положения МКТ подтверждаются многими опытными фактами. Существование молекул, атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул. Упругость газов, твердых и жидких тел, способность жидкостей
смачивать некоторые твердые тела, процессы окрашивания, склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами. Явление диффузии - способность молекул одного вещества проникать в промежутки между молекулами другого - тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавле-ния или путем давления. Подтверждением непрерывного хаотического движения молекул является также и броуновское движение - непрерывное хаотическое движение микроскопических частиц, нерастворимых в жидкости.
Движение броуновских частиц объясняется хаотическим движением частиц жидкости, которые сталкиваются с микроскопическими частицами и приводят их в движение. Опытным путем было доказано, что скорость броуновских частиц зависит от температуры жидкости. Теорию броуновского движения разработал А. Эйнштейн. Законы движения частиц носят статистический, вероятностный характер. Известен только один способ уменьшения интенсивности броуновского движения - уменьшение температуры. Существование броуновского движения убедительно подтверждает движение молекул.
Любое вещество состоит из частиц, поэтому количество вещества принято считать пропорциональным числу частиц, т. е. структурных элементов, содержащихся в теле, v.
Единицей количества вещества является моль. Моль - это количество вещества, содержащее столько же структурных элементов любого вещества, сколько содержится атомов в 12 г углерода С 12 . Отношение числа молекул вещества к количеству вещества называют постоянной Авогадро:
n a = N/v . na = 6,02 10 23 моль -1 .
Постоянная Авогадро показывает, сколько атомов и молекул содержится в одном моле вещества. Молярной массой называют величину, равную отношению массы вещества к количеству вещества:
М = m/v .
Молярная масса выражается в кг/моль. Зная молярную массу, можно вычислить массу одной молекулы:
m 0 = m/N = m/vN A = М/N A
Средняя масса молекул обычно определяется химическими методами, постоянная Авогадро с высокой точностью определена несколькими физическими методами. Массы молекул и атомов со значительной степенью точности определяются с помощью масс-спектрографа.
Массы молекул очень малы. Например, масса молекулы воды: т = 29,9 10 -27 кг.
Молярная масса связана с относительной молекулярной массой Mr. Относительная молярная масса - это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода С 12 . Если известна химическая формула вещества, то с помощью таблицы Менделеева может быть определена его относительная масса, которая, будучи выражена в килограммах, показывает величину молярной массы этого вещества.
Нас окружают разнообразные предметы. Мы можем увидеть, что это либо твердые тела, либо жидкости, либо газы. Возникает масса вопросов обо всем, что нас окружает. Ответы на многие вопросы дает молекулярно-кинетическая теория .
Молекулярно-кинетическая теория – это совокупность воззрений, используемых для описания наблюдаемых и измеряемых свойств вещества на основе изучения свойств атомов и молекул данного вещества, их взаимодействия и движения.
Основные положения молекулярно-кинетической теории
Все тела состоят из частиц – атомов, молекул, ионов.
Все частицы находятся в непрерывном хаотическом тепловом движении.
Между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Таким образом, в молекулярно-кинетической теории объектом исследования является система, состоящая из большого количества частиц – макросистема . Для объяснения поведения такой системы законы механики не применимы. Поэтому основным методом исследования является статистический метод изучения свойств вещества.
Для объяснения и предсказания явлений важно знать основные характеристики молекул :
- Размеры

Оценка размера молекулы может быть сделана как размер кубика a в котором содержится одна молекула, исходя из плотности твердых или жидких веществ и массы одной молекулы:

- Масса молекул
Отношение массы вещества m к числу молекул N в данном веществе:
- Относительная молекулярная масса
Отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода:
- Количество вещества
Количество вещества равно отношению числа частиц N в теле (атомов – в атомарном веществе, молекул – в молекулярном) к числу молекул в одном моле веществаN А:

- Постоянная Авогадро
Количество молекул, содержащихся в 1 моль вещества.
- Молярная масса
Молярной массой вещества называют массу вещества, взятого в количестве 1 моля.
В Международной системе единиц молярная масса вещества выражается в кг/моль .
- Взаимодействие (количественно на основе опытов)

Для взаимодействия молекул характерно одновременно и притяжение, и отталкивание: на расстояниях r
Молекулярно-кинетическая теория дает возможность понять, почему вещество может находиться в газообразном, жидком и твердом состояниях. С точки зрения МКТ агрегатные состояния различаются по значению среднего расстояния между молекулами и характеру движения молекул друг относительно друга .
Основные положения молекулярно-кинетической теории неоднократно подтверждались различными физическими экспериментами. Например, исследованием:
А) Диффузии
Б) Броуновского движения
Краткие итоги
Молекулярно-кинетическая теория объясняет строение и свойства тел на основе движения и взаимодействия атомов, молекул и ионов. В основе МКТ лежат три положения , которые полностью подтверждены экспериментально и теоретически:
1) все тела состоят из частиц – молекул, атомов, ионов;
2) частицы находятся в непрерывном хаотическом тепловом движении;
3) между частицами любого тела существуют силы взаимодействия – притяжения и отталкивания.
Молекулярное строение вещества подтверждается непосредственным наблюдением молекул в электронных микроскопах, а также растворением твердых веществ в жидкостях, сжимаемостью и проницаемостью вещества. Тепловое движение – броуновским движением и диффузией. Наличие межмолекулярного взаимодействия прочностью и упругостью твердых тел, поверхностным натяжением жидкостей.
Опорный конспект к уроку:

Вопросы для самоконтроля по блоку «Основные положения молекулярно-кинетической теории и их опытное обоснование»
- Сформулируйте основные положения молекулярно-кинетической теории.
- Какие наблюдения и эксперименты подтверждают основные положения молекулярно-кинетической теории?
- Что такое молекула? атом?
- Что называют относительной молекулярной массой? Какая формула выражает это понятие?
- Что называют количеством вещества? Какая формула выражает это понятие? Какова единица количества вещества?
- Что называют постоянной Авогадро?
- Что такое молярная масса вещества? Какая формула выражает смысл этого понятия? Какова единица молярной массы?
- Какова природа межмолекулярных сил?
- Какими свойствами обладают силы молекулярного взаимодействия?
- Как силы взаимодействия зависят от расстояния между ними?
- Опишите характер движения молекул в газах, жидкостях и твердых телах.
- Каков характер упаковки частиц у газов, жидкостей и твердых тел?
- Каково среднее расстояние между молекулами у газов, жидкостей и твердых тел?
- Перечислите основные свойства газов, жидкостей, твердых тел.
- Что называют броуновским движением?
- О чем свидетельствует броуновское движение?
- Что называют диффузией? Приведите примеры диффузии в газах, жидкостях и твердых телах.
- 18. Как зависит скорость диффузии от температуры тел?
Молекулярно-кинетическая теория - это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов, как мельчайших частиц вещества. В основе МКТ лежат три основных положения:1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов. 2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними. Основные положения МКТ подтверждаются многими опытными фактами. Существование молекул, атомов и ионов доказано экспериментально, молекулы достаточно изучены и даже сфотографированы с помощью электронных микроскопов. Способность газов неограниченно расширяться и занимать весь предоставленный им объем объясняется непрерывным хаотическим движением молекул. Упругость газов, твердых и жидких тел, способность жидкостей
смачивать некоторые твердые тела, процессы окрашивания, склеивания, сохранения формы твердыми телами и многое другое говорят о существовании сил притяжения и отталкивания между молекулами. Явление диффузии - способность молекул одного вещества проникать в промежутки между молекулами другого - тоже подтверждает основные положения МКТ. Явлением диффузии объясняется, например, распространение запахов, смешивание разнородных жидкостей, процесс растворения твердых тел в жидкостях, сварка металлов путем их расплавле-ния или путем давления. Подтверждением непрерывного хаотического движения молекул является также и броуновское движение - непрерывное хаотическое движение микроскопических частиц, нерастворимых в жидкости.
Движение броуновских частиц объясняется хаотическим движением частиц жидкости, которые сталкиваются с микроскопическими частицами и приводят их в движение. Опытным путем было доказано, что скорость броуновских частиц зависит от температуры жидкости. Теорию броуновского движения разработал А. Эйнштейн. Законы движения частиц носят статистический, вероятностный характер. Известен только один способ уменьшения интенсивности броуновского движения - уменьшение температуры. Существование броуновского движения убедительно подтверждает движение молекул.
Любое вещество состоит из частиц, поэтому количество вещества принято считать пропорциональным числу частиц, т. е. структурных элементов, содержащихся в теле, v.
Единицей количества вещества является моль. Моль - это количество вещества, содержащее столько же структурных элементов любого вещества, сколько содержится атомов в 12 г углерода С 12 . Отношение числа молекул вещества к количеству вещества называютпостоянной Авогадро:
n a = N/v. na =6,02 10 23 моль -1 .
Постоянная Авогадро показывает, сколько атомов и молекул содержится в одном моле вещества.Молярной массойназывают величину, равную отношению массы вещества к количеству вещества:
Молярная масса выражается в кг/моль. Зная молярную массу, можно вычислить массу одной молекулы:
m 0 = m/N = m/vN A = М/N A
Средняя масса молекул обычно определяется химическими методами, постоянная Авогадро с высокой точностью определена несколькими физическими методами. Массы молекул и атомов со значительной степенью точности определяются с помощью масс-спектрографа.Массы молекул очень малы. Например, масса молекулы воды: т = 29,9 10 -27 кг.
Молярная масса связана с относительной молекулярной массой Mr. Относительная молярная масса - это величина, равная отношению массы молекулы данного вещества к 1/12 массы атома углерода С 12 . Если известна химическая формула вещества, то с помощью таблицы Менделеева может быть определена его относительная масса, которая, будучи выражена в килограммах, показывает величину молярной массы этого вещества.
2) Колебательное движение молекул в природе и технике. Гармонические колебания. Амплитуда, период, частота и фаза колебаний. Опредеолить опытным путём частоту предложенной колебательной системы.
Механическими колебаниями называют движения тел, повторяющиеся точно или приблизительно одинаково через одинаковые промежутки времени. Силы, действующие между телами внутри рассматриваемой системы тел, называют внутренними силами. Силы, действующие на тела системы со стороны других тел, называют внешними силами. Свободными колебаниями называют колебания, возникшие под воздействием внутренних сил, например – маятник на нитке. Колебания под действиями внешних сил – вынужденные колебания, например – поршень в двигателе. Общим признаков всех видов колебаний является повторяемость процесса движения через определенный интервал времени. Гармоническими называются колебания, описываемые уравнением. В частности колебания, возникающие в системе с одной возвращающей силой, пропорциональной деформации, являются гармоническими. Минимальный интервал, через который происходит повторение движения тела, называется периодом колебаний Т . Физическая величина, обратная периоду колебаний и характеризующая количество колебаний в единицу времени, называется частотой. Частота измеряется в герцах, 1 Гц = 1 с -1 . Используется также понятие циклической частоты, определяющей число колебаний за 2p секунд. Модуль максимального смещения от положения равновесия называется амплитудой. Величина, стоящая под знаком косинуса – фаза колебаний, j 0 – начальная фаза колебаний. Производные также гармонически изменяются, причем, а полная механическая энергия при произвольном отклонении х (угол, координата, и т.д.) равна, где А и В – константы, определяемые параметрами системы. Продифференцировав это выражение и приняв во внимание отсутствие внешних сил, возможно записать, что, откуда.
Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые явления в макроскопических телах и внутренние свойства этих тел движением и взаимодействием атомов, молекул и ионов, из которых состоят тела. В основе МКТ строения вещества лежат три положения:
- Вещество состоит из частиц – молекул, атомов и ионов. В состав этих частиц входят более мелкие элементарные частицы. Молекула – наименьшая устойчивая частица данного вещества. Молекула обладает основными химическими свойствами вещества. Молекула является пределом деления вещества, то есть самой маленькой частью вещества, которая способна сохранять свойства этого вещества. Атом – это наименьшая частица данного химического элемента.
- Частицы, из которых состоит вещество, находятся в непрерывном хаотическом (беспорядочном) движении.
- Частицы вещества взаимодействуют друг с другом – притягиваются и отталкиваются.
Эти основные положения подтверждаются экспериментально и теоретически.
Состав вещества
Современные приборы позволяют наблюдать изображения отдельных атомов и молекул. С помощью электронного микроскопа или ионного проектора (микроскопа) можно получить изображения отдельных атомов и оценить их размеры. Диаметр любого атома имеет порядок d = 10 -8 см (10 -10 м). Размеры молекул больше размеров атомов. Поскольку молекулы состоят из нескольких атомов, то чем больше количество атомов в молекуле, тем больше её размер. Размеры молекул лежат в пределах от 10 -8 см (10 -10 м) до 10 -5 см (10 -7 м).
Хаотическое движение частиц
Непрерывное хаотическое движение частиц подтверждается броуновским движением и диффузией. Хаотичность движения означает, что у молекул не существует каких-либо предпочтительных путей и их движения имеют случайные направления. Это означает, что все направления равновероятны.
Диффузия (от латинского diffusion – растекание, распространение) – явление, когда в результате теплового движения вещества происходит самопроизвольное проникновение одного вещества в другое (если эти вещества соприкасаются).
Взаимное перемешивание веществ происходит по причине непрерывного и беспорядочного движения атомов или молекул (или других частиц) вещества. С течением времени глубина проникновения молекул одного вещества в другое увеличивается. Глубина проникновения зависит от температуры: чем выше температура, тем больше скорость движения частиц вещества и тем быстрее протекает диффузия.
Диффузия наблюдается во всех состояниях вещества – в газах, жидкостях и твёрдых телах. Примером диффузии в газах служит распространение запахов в воздухе при отсутствии прямого перемешивания. Диффузия в твёрдых телах обеспечивает соединение металлов при сварке, пайке, хромировании и т.п. В газах и жидкостях диффузия происходит намного быстрее, чем в твёрдых телах.
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения и отталкивания). Этими же причинами объясняется малая сжимаемость жидкостей и способность твёрдых тел сопротивляться деформациям сжатия и растяжения.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны. По электрическим свойствам молекулу можно приближённо рассматривать как электрический диполь.
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рис. 1.1. Здесь показаны проекции сил взаимодействия на прямую, которая проходит через центры молекул.
Рис. 1.1. Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видим, по мере уменьшения расстояния между молекулами r сила притяжения F r пр увеличивается (красная линия на рисунке). Как уже было сказано, силы притяжения принято считать отрицательными, поэтому по мере уменьшения расстояния кривая уходит вниз, то есть в отрицательную зону графика.
Силы притяжения действуют по мере сближения двух атомов или молекул, пока расстояние r между центрами молекул находится в районе 10 -9 м (2-3 диаметра молекул). По мере увеличения этого расстояния силы притяжения ослабевают. Силы притяжения являются короткодействующими силами.
где a – коэффициент, зависящий от вида сил притяжения и строения взаимодействующих молекул.
При дальнейшем сближении атомов или молекул на расстояниях между центрами молекул порядка 10 -10 м (это расстояние сравнимо с линейными размерами неорганических молекул) появляются силы отталкивания F r от (синяя линия на рис. 1.1). Эти силы появляются за счёт взаимного отталкивания положительно заряженных атомов в молекуле и убывают с увеличением расстояния r ещё быстрее, чем силы притяжения (что видно на графике – синяя линия более «круто» стремится к нулю, чем красная).
где b – коэффициент, зависящий от вида сил отталкивания и строения взаимодействующих молекул.
На расстоянии r = r 0 (это расстояние примерно равно сумме радиусов молекул) силы притяжения уравновешивают силы отталкивания, а проекция результирующей силы F r = 0. Этому состоянию соответствует наиболее устойчивое расположение взаимодействующих молекул.
В общем случае результирующая сила равна:
При r > r 0 притяжение молекул превосходит отталкивание, при r < r 0 – отталкивание молекул превосходит их притяжение.
Зависимость сил взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм появления сил упругости в твёрдых телах.
При растяжении твёрдого тела частицы удаляются друг от друга на расстояния, превышающие r 0 . При этом появляются силы притяжения молекул, которые возвращают частицы в первоначальное положение.
При сжатии твёрдого тела частицы сближаются на расстояния, меньшие расстояния r 0 . Это приводит к увеличению сил отталкивания, которые возвращают частицы в первоначальное положение и препятствуют дальнейшему сжатию.
Если смещение молекул из положений равновесия мало, то силы взаимодействия растут линейно с увеличением смещения. На графике этот отрезок показан утолщённой линией светло-зелёного цвета.
Поэтому при малых деформациях (в миллионы раз превышающих размер молекул) выполняется закон Гука, согласно которому сила упругости пропорциональна деформации. При больших смещениях закон Гука не действует.
12. Основные положения молекулярно-кинетической теории и их опытное обоснование. Масса и размеры молекул
Теорию, объясняющую строение и свойства тел на основе закономерностей движения и взаимодействия частиц, из которых состоят тела, называют молекулярно-кинетической.
Основные положения молекулярно-кинетической теории (МКТ) формулируются следующим образом:
Любое вещество имеет дискретное (прерывистое) строение. Оно состоит из отдельных частиц (молекул, атомов, ионов), разделенных промежутками.
Частицы находятся в состоянии непрерывного хаотического движения, называемого тепловым.
Частицы взаимодействуют друг с другом. В процессе их взаимодействия возникают силы притяжения и отталкивания.
Справедливость МКТ подтверждается многочисленными наблюдениями и фактами.
Наличие у веществ проницаемости, сжимаемости и растворимости свидетельствует о том, что они не сплошные, а состоят из отдельных, разделенных промежутками частиц. С помощью современных методов исследования (электронные и ионные микроскопы) получены изображения наиболее крупных молекул.
Броуновское движение и диффузия свидетельствуют о том, что частицы находятся в непрерывном движении.
Наличие прочности и упругости тел, явления смачивания, поверхностного натяжения в жидкостях и т.д. доказывают существование сил взаимодействия между молекулами.
Масса и размеры молекул.
Размер молекул является величиной условной. Его оценивают следующим образом. Между молекулами наряду с силами притяжения действуют и силы отталкивания, поэтому молекулы могут сближаться лишь до некоторого расстояния. Расстояние предельного сближения центров молекул называют эффективным диаметром молекулы. (При этом условно считают, что молекулы имеют сферическую форму.)
С помощью многочисленных методов определения масс и размеров молекул установлено, что за исключением молекул органических веществ, содержащих очень большое число атомов, большинство молекул по порядку величины имеют диаметр 1· 10 - 10 м и массу 1· 10 - 26 кг.
Относительная молекулярная масса.
Относительной молекулярной (или атомной) массой М r (или А r ) называют величину, равную отношению массы молекулы (или атома) m о этого вещества к 1/12 массы атома углерода m оС, т.е.
Относительная молекулярная (атомная) масса является величиной, не имеющей размерности.
Количество вещества. Молярная масса. Масса молекулы.
Количеством вещества ν называют величину, равную отношению числа молекул (или атомов) N в данном теле к числу атомов N A в 0,012 кг углерода, т.е. ν = N/ N A (N A - число Авогадро).
Молярной массой М какого-либо вещества называют массу 1 моль этого вещества.
Следовательно, массу молекулы (атома) можно определить из соотношения
13. Идеальный газ. Основное уравнение мкт идеального газа
Идеальным называют такой газ, при описании свойств которого делают следующие допущения: не учитывают собственный размер газовых молекул и не учитывают силы взаимодействия между ними.
Таким образом, моделью идеального газа является совокупность хаотически движущихся материальных точек, взаимодействующих между собой и со стенками содержащего газ сосуда только при непосредственном столкновении.